Eksokrin pankreas insuffisiens
Hva er eksokrin pankreas insuffisiens (EPI)?
Hva er eksokrin pankreas insuffisiens (EPI)?
Eksokrin pankreas insuffisiens (EPI) er en tilstand med redusert produksjon av pankreasenzymer. Spesielt lipase som spalter fett, men også amylase og protease som spalter karbohydrater og proteiner. Dette fører til mangelfull spalting av næringsstoffer i kosten og underernæring. EPI er en vanlig årsak til malabsorpsjon. Dette fører til symptomer som mageubehag, oppblåsthet, flatulens, diaré, vekttap og steatoré.1,2
EPI er en vanlig og potensiell livstruende tilstand. Dette fordi reduksjon i matspaltingsenzymer fører til underernæring.1 Det er mange bakenforliggende årsaker til tilstanden som ikke bare er begrenset til reduksjon i enzym produksjonen.
Det er tre hovedårsaker til mangel på pankreasenzymer:5
- Redusert produksjon av enzymer på grunn av skade på pankreas
- Redusert stimulering av enzymproduksjon
- Mangelfull levering av enzymer til duodenum på grunn av duktal obstruksjon
Når pankreas ikke produserer nok enzymer til å fordøye maten fører dette til EPI, som igjen fører til malabsorpsjon og underernæring.5,7
Pasienter med EPI har ofte magesmerter, diaré, og uønsket vektnedgang.5,7 Underernæring kan føre til vitaminmangel. Særlig fettløselige vitaminer som D-vitamin.5,7
EPI øker risikoen for underernæring, noe som kan påvirke utfallet av den underliggende sykdommen, som igjen påvirker dødelighet, sykelighet og livskvalitet.6
Dårlig fordøyelse kan føre til mangelfullt opptak av næringsstoffer og vitaminer.5
Udiagnostisert eller utilstrekkelig behandling av EPIkan føre til:5,7
- Vektnedgang, underernæring og mangel på fettløselige vitaminer (A, D, E og K)5,7
- Økt risiko for osteoporose5,7
- Økt risiko for kardiovaskulær hendelse7
Hos pasienter med kronisk pankreatitt kan økt kardiovaskulær risiko skyldes redusert nivå av HDL-kolesterol, som beskytter mot hjerte-/karsykdom.
Fakta
Pankreas eksokrine funksjon har en stor reservekapasitet. Derfor vil de kliniske symptomene på enzymmangel ikke oppstå før funksjonen er nede på 10% av en frisk pankreas.10
Diagnostisering av EPI
Det er forskjellige tester som brukes for diagnostisering av EPI Disse kan enten være direkte tester, eller indirekte.2
Indirekte tester analyserer konsekvensene av EPI ved å måle endringer i utskillelse av enzymer fra pankreas. Disse testene er lettere å utføre, samt at de er rimeligere enn direkte tester.1 Direkte tester evaluerer direkte pankreas sin sekresjon av enzymer. Selv om disse er mer nøyaktig så er de ikke foretrukket som førstelinje test. Dette fordi de er invasive, tidkrevende og dyre.1
Les mer om diagnostisering av epi
Behandling av EPI
Formålet med behandling av EPI er å normalisere fordøyelsen, forbedre EPI-relaterte symptomer og hindre følgetilstander og progresjon av underernæring.
Pankreas enzymsubstitusjonsbehandling , sammen med diett og livsstilsveiledning er basisbehandlingen ved EPI. Ettersom sykdomsforløp, ernæringsstatus og symptomer kan variere fra pasient til pasient, må dosen settes etter dette.5
Les mer om behandling av EPI
Referanser:
- Capurso G, TrainiM, Piciucchi M, et al. Exocrine pancreatic insufficiency: Prevalence, diagnosis, and management. Clin Exp Gastroenterol. 2019;12:129–139.
- Dominguez-Muñoz JE. Diagnosis and treatment of pancreatic exocrine insufficiency. Current Opinion in Gastroenterology. 2018;34(5):349–354.
- Relations between Pancreatic Enzyme Outputs and Malabsorption in Severe Pancreatic Insufficiency, .Eugene P. DiMagno, M.D., Vay L. W. Go, M.D., and W. H. J. Summerskill, M.D. April 19, 1973 N Engl J Med 1973; 288:813-815
- Othman MO, Harb D, and Barkin JA. Introduction and practical approach to exocrine pancreatic insufficiency for the practicing clinician. Int J Clin Pract. 2018;72:e13066.
- Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency. World J Gastroenterol 2013;19(42):7258–7266.
- Ockenga J. Importance of nutritional management in diseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Sikkens EC, Cahen DL, Kuipers EJ, et al. Pancreatic enzyme replacement therapy in chronic pancreatitis. Best Pract Res Clin Gastroenterol. 2010;24:337-47. 2017;23(39):7059-7076.
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl 6):vi1-28.
- Leeds JS, Oppong K, Sanders DS. The role of fecal elastase-1 in detecting exocrine pancreatic disease. Nat Rev Gastroenterol Hepatol. 2011;8:405-15.
- Singh VK, Haupt ME, Geller DE, et al. Less common etiologies of exocrine pancreatic insufficiency. World J Gastroenterol. 2017;23(39):7059-7076.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Fitzsimmons D, Kahl S, Butturini G, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Sikkens EC, Cahen DL, Koch AD, et al. The prevalence of fat-soluble vitamin deficiencies and a decreased bone mass in patients with chronic pancreatitis. Pancreatology. 2013;13(3):238-42.
- Tignor AS, Wu BU, Whitlock TL, et al. High prevalence of low-trauma fracture in chronic pancreatitis, Gastroenterol. 2010;105(12):2680-2686.
- Janice Sorensen, Jens Kondrup, Jacek Prokopowicz, et al, EuroOOPS: an international, multicentre study to implement nutritional risk screening and evaluate clinical outcome, Clin Nutr. 2008 Jun;27(3):340-9.
Diagnostisering av EPI
Pasienter med magesmerter som øker ved inntak av fet mat, diaré, ernæringssvikt og uønsket vekttap bør utredes for mulig EPI.1
Det fins flere tilgjengelige tester for EPI, med varierende pris og kvalitet.1
Selv om invasive tester har høyere sensitivitet er de mindre egnet, på grunn av høy pris og fordi de er mer inngripende enn ikke invasive tester.1
Invasive tester som er tilgjengelig i Norge er endoskopisk sekretintest, c13-blandet triglyserid-pusteprøve og sekretin-MR. Måling av fett i avføring over tre døgn utføres i dag i veldig sjelden.2
Ikke invasive tester er derfor mer tilgjengelig og er mest brukt i klinikken. Les mere om de forskjellige testmetodene her.
Fekal elastase test for pankreasfunksjon (Elastase-1 test)
Denne måler nivået av Elastase1 enzymer i avføringen.3,4
Den krever bare at pasienten tar en enkel avføringsprøve. Elastase-1 test er derfor den mest brukte testen i klinikker.3
Fekal elastase-1 (FE-1) testen er rimelig, enkel for pasienten, lett tilgjengelig og er derfor den foretrukne testen i klinikker. Det er konsensus i fagmiljøene at lave Elastase-1 verdier er forenelig med eksokrin pankreas insuffisiens (EPI).5
Måling av fett i feces
Krever oppsamling av all avføring i tre dager. Dette er en nøyaktig metode for å diagnostisere EPI.1
Testen var tidligere gullstandard for diagnostisering av EPI, men bruken i dag begrenser seg til studier. Den er vanskelig å gjennomføre både for pasienter og for laboratoriet. Testen skiller heller ikke på om årsaken til EPI er direkte relatert til skade i pankreas, eller utenom pankreas, og har derfor en veldig liten plass i utredningen i dag.1
13C pusteprøve for EPI
Denne metoden måler metabolismen av radioaktivt (13C) fra bukspyttkjertelenzymer.6
Testen er enkel å gjennomføre. Den er veldig sikker og reproduserbar.6
Radioaktivt (13C-blandet triglyserid, MTG) gis oralt sammen med et testmåltid.6
- En andel substrater metaboliseres av bukspyttkjertelenzymer
- Videre metabolisme av disse produktene gir 13CO2 som frigjøres ved utpusting
Mengden av 13CO2 i utpustet luft kan måles ved spektrometri eller infrarød analyse og er relatert til bukspyttkjertelfunksjon.
Sensitiviteten til pusteprøven for diagnostisering av malabsorpsjon er høyere enn 90%.6
Fakta
Hos pasienter med kronisk pankreatitt har sensitiviteten for Elastase-1 testen vist seg å være opptil 63% for mild til moderat EPI, og fra 77-100% for moderat til alvorlig EPI. Kilde: Smith RC, et al. 20151
Referanser:
- Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency. World J Gastroenterol 2013;19(42):7258–7266.
- Trond Engjom, Anne Waage, Dag Hoem, et al, Kronisk pankreatitt – utredning og behandling, Tidsskr Nor Legeforening, 5 februar 2018.
- Sikkens EC, Cahen DL, Kuipers EJ, et al. Pancreatic enzyme replacement therapy in chronic pancreatitis. Best Pract Res Clin Gastroenterol. 2010;24:337-47.
- Leeds JS, Oppong K, Sanders DS. The role of fecal elastase-1 in detecting exocrine pancreatic disease. Nat Rev Gastroenterol Hepatol. 2011;8:405-15.
- Lohr JM, Dominguez-Muñoz JE, Rosendahl J, et al. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterology Jornal 2017; Vol 5(2)153-199.
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12-16
Behandling av EPI
Enzymtilskuddsbehandling (Pankreatin) er førstelinjebehandling for EPI.1 Målet med behandlingen er å levere nok enzymer i duodenum samtidig som maten passerer. Dette fører til en god absorpsjon av næringsstoffer i maten og forbedrer ernæringsstatus.1
- Supplerende behandling til Pankreatin:2,3
- Livsstilsendring (for eksempel små hyppige måltider, unngå mat som er tungtfordøyelig, begrense alkoholinntak, røykeslutt
- Tilskudd av vitaminer (særlig fettløselige som A, D, E og K)
Fakta
Enzymmangel fører til at maten du spiser ikke blir tilstrekkelig fordøyd. Derfor er målet med behandlingen å levere nok enzymer i duodenum samtidig som maten passerer. Dette sørger for en god absorpsjon av næringsstoffer i maten og forbedrer ernæringsstatus.1
Hvordan virker pankreatin?4
Pankreatin dosering
Riktig pankreatin dose er viktig for en effektiv behandling.1
Norsk veileder for diagnostikk og behandling av kronisk pankreatitt:7
«Behandling med pankreasenzymer indisert hos pasienter med kronisk pankreatitt og eksokrin pankreasinsuffisiens.
Vanlig dosering er 40.000-80.000 IE lipase til store måltider og 25.000-40.000 IE til mindre måltider. Doseringen bør individuelt tilpasses pasientens kostvaner. Høyere doser kan være nødvendig i enkelte tilfeller. En frisk pankreas skiller ut ca. 200.000 lipaseenheter til et større måltid.7
Protonpumpehemmere kan forsøkes ved manglende eller suboptimal effekt av pankreasenzymer.7
Individualisering av pankreatindose
Selv om pasienter får samme startdose, er det viktig å følge opp pasienter, og regulere dosen i forhold til responsen de får på behandlingen.1
Forsiktighet eller nedjustering bør vurderes ved abdominale symptomer (som vanligvis ikke oppleves av pasienten) eller endringer i abdominale symptomer.8 Dette for å utelukke muligheten for kolonskader - spesielt hvis pasienten tar mer enn 10.000 enheter lipase/kg/ dag.9 Dette ser man stort sett kun hos barn med cystisk fibrose som får høye doser i forhold til vekten.6
Det er viktig at pasienten forstår hvorfor han får enzymer. Hvordan en frisk pankreas produserer enzymer og hvordan Pankreatin erstatter disse.4,5 Dette vil føre til at pasienten ser viktigheten av å ta pankreatin sammen med måltider for å bedre ernæring.4,5
Hvorfor pankreatin behandling?
En frisk pankreas skiller ut ca. 720 000 lipaseenheter som respons på et måltid på 300-600 kcal. Pankreas kan samtidig redusere denne kapasiteten mot 90% uten at det fører til malabsorpsjon.9 Pankreatin vil derfor supplere pankreas eksokrine sekresjon for å gjøre den likere en frisk pankreas. Dette fordi pankreatin inneholder alle enzymer (lipase, amylase og protease) som en person med EPI har for lite av.1
Dosering av pankreatin hos spedbarn og barn: Creon® 10000, 25000, 40000 SPC punkt 4.2 (30.12.2020)
Dosering ved cystisk fibrose
Barn:
I den pediatriske aldersgruppen anbefales det å starte med en dosering på 1000 Ph. Eur lipaseenheter per kilo kroppsvekt per måltid hos barn under fire år, og med 500 Ph.Eur. lipaseenheter per kg kroppsvekt per måltid hos barn i alderen fire år og eldre.
Dosen som trengs i denne populasjonen kan derfor måtte fastsettes med doseringsformer som inneholder færre lipaseenheter (f.eks. 10 000 eller 5000 Ph.Eur. lipaseenheter).9
Referanser:
- Lindkvist B. Diagnosis and treatment of pancreatic exocrine insuffciency. World J Gastroenterol.2013;19(42):7258–7266.
- Domínguez‐Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12–16.
- Löhr JM, Oliver MR, Frulloni L. Synopsis of recent guidelines on pancreatic exocrine insufficiency. United European Gastroenterology Journal. 2013;1:79–83
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl 6):vi1–28.
- Imrie CW, Connett G, Hall RI, et al. Review article: enzyme supplementation in cystic fibrosis, chronic pancreatitis, pancreatic and periampullary cancer. Aliment Pharmacol Ther. 2010;32(Suppl 1):1–25.
- Creon 10000, 20000, 35000 SPC punkt 4.4 (01.11.2021)
- Norsk veileder for diagnostikk og behandling av kronisk pankreatitt, NGF-Nytt nr 4. – Desember 2016
- Creon 10000, 20000, 35000 SPC punkt 4.9 (01.11.2021)
- Creon 10000, 20000, 35000 SPC punkt 4.2 (01.11.2021)
EPI og bakenforliggende sykdom
Eksokrin pankreas insuffisiens (EPI) er en tilstand med redusert mengde av pankreasenzymer og redusert aktivitet i pankreas. Noe som fører til utilstrekkelig absorpsjon av kosten.2 Det er tre hovedgrunner til utilstrekkeligmengde pankreas enzymer.2
- Redusert kapasitet på pankreas på grunn av tap eller skade på pankreasvev.
- Redusert stimulering av enzym produksjon på grunn av forstyrrelser i hormonell feedback
- Begrenset levering av enzymer i duodenum på grunn av obstruksjon i pankreas ductus
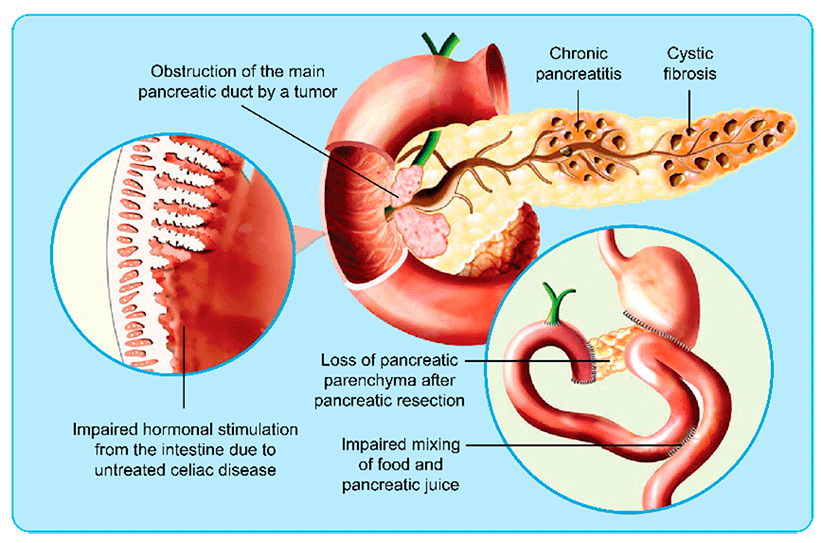
Eksokrin pankreasinsuffisiens er en konsekvens av ulike pankreas skader så vel som tilstander utenfor pankreas.1 Bukspyttkjertelsykdommer som fører til EPI inkluderer akutt pankreatitt (AP), kronisk pankreatitt (CP), cystisk fibrose (CF), kreft i bukspyttkjertelen og kirurgi i bukspyttkjertelen.De vanligste tilstandene utenfor bukspyttkjertelen som fører til EPI er: cøliaki, inflammatorisk tarmsykdom (IBD) og gastrisk kirurgi.1
Figure 1: Pathology of pancreatic exocrine insufficiency4
Prevalens av EPI i kliniske diagnoser
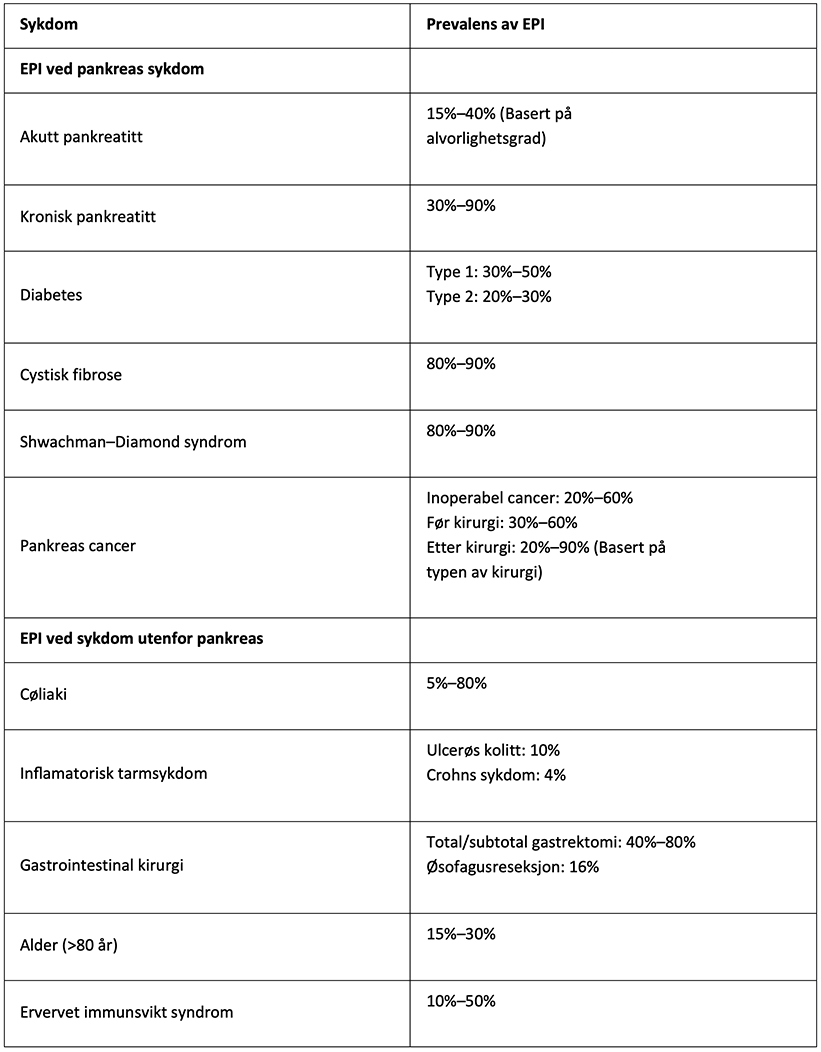
Prevalens av EPI generelt i befolkningen er ukjent. Vanligvis kommer EPI som et resultat av sykdom som påvirker pankreas sin funksjon direkte eller indirekte. Prevalensen er høy hos pasienter med kronisk pankreatitt, cystisk fibrose, pankreas cancer og etter pankreas kirurgi. Eksokrin pankreas insuffisiens kan også komme som følge av sjeldne genetiske sykdommer som Shwachman–Diamond syndrom.1 (Figur 1) Prevalens av EPI øker med alder.2,3
Tabell 1: Prevalens av EPI med underliggende sykdommer.2
Symptomer og konsekvenser av EPI
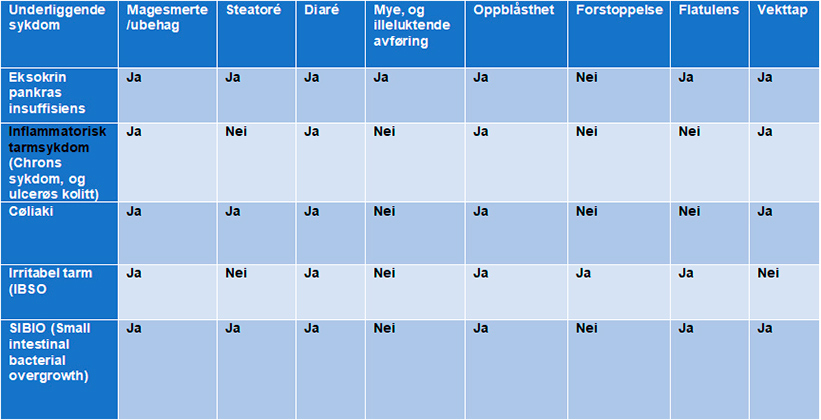
Symptomer og alvorlighetsgrad av EPI varierer mye fra pasient til pasient. De typiske symptomene av EPI inkluderer steatoré, diaré oppblåsthet, magesmerte, flatulens, og uønsket vekttap.4 Disse er ofte like for andre gastrointestinale sykdommer (Figur 2), derfor kan det være vanskelig å stille riktig diagnose.3
Tabell 2: Symptomer på EPI og andre gastrointestinale relaterte sykdommer.3
Pankreas har en stor reservekapasitet, samt at kroppen har kompensasjonsmekanismer som til en viss grad kan erstatte tap av pankreasenzymer.4 Derfor vil ofte symptomene på EPI ikke oppstå før lipasenivåene er nede på 5-10% av normalproduksjon.4
EPI, dersom ubehandlet kan forårsake alvorlige mangler på fettløselige vitaminer, proteiner og sporstoffer som magnesium og sink. EPI gir også økt risiko for osteoporose, lavenergibrudd, sarkopenia og kardiovaskulær sykdom. Alt dette fører til at EPI ofte gir redusert livskvalitet.5
Diagnostisering av EPI
Det er flere tilgjengelige metoder for diagnostisering av EPI. Forenklet kan man kategorisere disse i direkte og indirekte tester.2
Indirekte tester evaluerer konsekvensene av EPI ved å måle mengden enzymer fra pankreas. Disse er rimeligere og enklere å ta sammenlignet med direkte pankreas funksjonstester.2 De testene som evaluerer pankreasfunksjonen direkte har bedre sensitivitet Fordi de direkte testene er tidkrevende, inngripende for pasienten og dyre så er de mindre brukt i klinikken enn indirekte tester.2
Behandling av EPI
Den primære målsettingen for behandling av EPI er å normalisere ernæringen, behandle EPI relaterte symptomer, forhindre underernæringsrelatert sykdom og bremse sykdomsforløpet.6 Enzym erstatning (pankreatin), sammen med kostholds og livsstilsråd er førstelinjebehandling.4 Siden alvorlighetsgrad og symptomer varierer fra pasient til pasient, bør også pankreatin dosen tilpasses individuelt. Denne bør justeres basert på symptomlindringen og ernæringsstatus. Figur 2 presenterer en algoritme for behandling av EPI ved forskjellig kliniske tilstander.5
Andre faktorer som røykeslutt, alkoholkonsum, kosthold, riktig pankreatindose og compliance påvirker også resultat av behandlingen. Systematisk oppfølging av behandling er derfor viktig for å evaluere effekten og justere behandlingen.6
Figur 2: Algorytme for behandling av EPI ved forskjellige
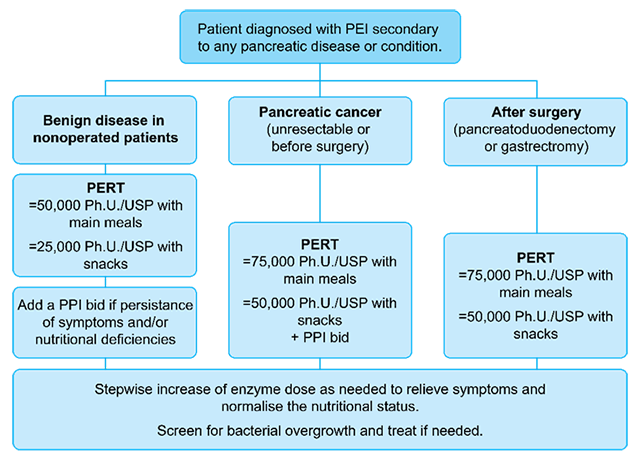
Algorithm adapted from Dominguez-Muñoz JE. Current Opinion in Gastroenterology. 2018;34(5):349–354.
Referanser:
- Creon 10000, 20000, 35000 SPC punkt 4.1 (01.11.2021)
- Capurso G, Traini M, Piciucchi M, et al. Exocrine pancreatic insufficiency: Prevalence, diagnosis, and management. Clin Exp Gastroenterol. 2019;12:129–139.
- Othman MO, Harb D, and Barkin JA. Introduction and practical approach to exocrine pancreatic insufficiency for the practicing clinician. Int J Clin Pract. 2018;72:e13066.
- Lindkvist B. Diagnosis and treatment of pancreatic exocrine insuffciency. World J Gastroenterol.2013;19(42):7258–7266.
- Dominguez-Muñoz JE. Diagnosis and treatment of pancreatic exocrine insufficiency. Current Opinion in Gastroenterology. 2018;34(5):349–354.
- Trond Engjom, Anne Waage, Dag Hoem et al. Tidsskrift Nor Legeforening, Utgave 3, 6. februar 2018
EPI og akutt pankreatitt
Eksokrin pankreas insuffisiens (EPI) er vanlig hos pasienter etter alvorlige tilfeller av akutt pankreatitt.3 Ca. 6.2% av pasienter med akutt pankreatitt utvikler alvorlig EPI,4 og ca. 29% utvikler mild til moderat EPI.4
Graden av EPI kan variere etter sykdomsforløpet. Det er derfor viktig med nøye oppfølging av pasient etter et tilfelle av akutt pankreatitt.4
Akutt pankreatitt er en vanlig betennelsestilstand som blir trigget av uregulert aktivering av trypsin i pankreas acinære celler.1 Den mest vanlige bakenforliggende årsaken er gallestein, eller høyt alkoholkonsum.1,2
Det kan være tilfeller hvor man ikke kan finne årsak, samt at det i andre tilfeller kan være flere faktorer som spiller inn.2
Eksokrin pankreas insuffisiens er vanlig hos pasienter etter alvorlige tilfeller av akutt pankreatitt .2,3
Ca. 6.2% av pasienter med akutt pankreatitt utvikler alvorlig EPI og ca. 29% utvikler mild til moderat EPI.4 Pasienter med historie av alkoholmisbruk, og tidligere episoder av nekrotiserende akutt pankreatitt har økt risiko for EPI.5 Alvorligheten av EPI er relatert til graden av pankreasnekrose.3
Hos pasienter med mild, ødematøs akutt pankreatitt er som regel eksokrin pankreas funksjon svekket kun i den første fasen etter tilfellet. Hos de fleste av disse vil funksjonen bli normalisert.6
Symptomer på EPI etter akutt pankreatitt er magesmerter, abdominal distensjon, diaré og statoré.4
Hvordan akutt pankreatitt fører til EPI
Selv om de eksakte virkningsmekanismer for utviklingen av EPI hos pasienter med akutt pankreatitt ikke er kjent, så er det studier som indikerer at reduksjon i pankreasenzymer er et resultat av redusert frigjøring i de acinære celler, fra obstruksjon i pankreatisk ductus,2 eller som en kombinasjon av disse to faktorene. En reduksjon i frigjøring av enzymene amylase og lipase fra de acinære cellene er ofte til stede:2
- På grunn av reduksjon i volum på den virksomme delen av bukspyttkjertelen
- Sekundært på grunn av svekket hormonell tilbakemelding fra mediatorer som stimulerer enzymproduksjonen
- På grunn av svekkelse i nevrale stimuli. F.eks. svekkelse i nevrale mediatorer på grunn av betennelse i pankreas
- På grunn av redusert syntese av proenzymer, eller obstruksjon i pankreas ductus
Akutt pankreatitt vil også kunne lede til kronisk pankreatitt som er en stor risiko faktor for EPI.2
Diagnostisering og behandling av EPI hos pasienter med akutt pankreatitt
Diagnostisering av EPI blir vanligvis gjort på bakgrunn av pasientens symptomer (vanligvis diaré), økt mengde fett i avføringen eller lave nivåer av fekal elastase 1.
Behandling av EPI for pasienter med akutt pankreatitt består blant annet av pankreas erstatningsbehandling (pankreatin). Her er noen anbefalinger før behandling med pankreatin:1,2,6
- Kostholdsveiledning bør bli gitt til alle pasienter etter akutt pankreatitt. Pasienter med fortsatte symptomer på malabsorpsjon bør bli vurdert for pankreatin.1
- Under konvalensen etter en alvorlig akutt pankreatitt, vil den eksokrine pankreasfunksjonen tilbakevende i varierende grad. Derfor bør pankreatin anbefales i opptil to år for alle pasienter etter en alvorlig hendelse av akutt pankreatitt, uavhengig av symptomer.1,2
Langtidsoppfølging
Graden av EPI endres over tid etter en episode av akutt pankreatitt.7 Pankreas funksjonen gjenopprettes gradvis. Mange vil få tilbake pankreasfunksjonen, men noen vil få en varig svekket funksjon, og oppfølgingen bør tilpasses alvorlighetsgraden.1,7
Referanser:
- K. Vengadakrishnan and A. K. Koushik: A study of the clinical profile of acute pancreatitis and its correlation with severity indices. Int J Health Sci (Qassim). 2015 Oct; 9(4): 410–417.
- Sand J, Nordback I. Acute pancreatitis: Risk of recurrence and late consequences of the disease. Nat Rev Gastroenterol Hepatol. 2009;6:470–477.
- Boreham B, Ammori BJ. A prospective evaluation of pancreatic exocrine function in patients with acute pancreatitis: Correlation with extent of necrosis and pancreatic endocrine insufficiency. Pancreatology.2003;3:303–308.
- Tu Jianfeng, Zhang J, Ke L, et al. Endocrine and exocrine pancreatic insufficiency after acute pancreatitis: Long-term follow-up study. BMC Gastroenterol. 2017;17(1):114.
- Hollemans RA, Hallensleben NDL, Mager DJ, et al. Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis. Pancreatology. 2018;18(3):253–262.
- Kahl S, Schutte K, Glasbrenner B. The effect of oral pancreatic enzyme supplementation on the course and outcome of acute pancreatitis: A randomized, double-blind parallel-group study. J Pancreas. 2014;15(2):165–174
- Robbert A. Hollemans , Nora Hallensleben, David J. Mager, Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis, Pancreatology. 2018 Apr;18(3):253-262
EPI og kronisk pankreatitt
Kronisk pankreatitt er den vanligste årsaken til EPI.1
Det er forskjellige årsaker til at man får kronisk pankreatitt, og betennelsen fører til permanent tap av pankreasvev og svekket funksjon.2 Både den endokrine og den eksokrine delen kan få varig svekkelse.2 Hos pasienter med kronisk pankreatitt, vil vevstap resultere i EPI på grunn av svekket evne til å produsere pankreasenzymer.1
Insidensen av kronisk pankreatitt i vestlige land varier fra 3,5 til 10 pr. 100 000 innbyggere,2 og øker med alderen.3 Prevalensen er estimert til å være mellom 120-143, pr 100,00012, og er mest vanlige blant voksne menn.3 Prevalensen av EPI blant denne gruppen varierer med alvorlighetsgraden av kronisk pankreatitt. Estimert til 30% ved mild KP og 85% ved alvorlig.3
Årsaker
Kronisk pankreatitt kan være forårsaket av miljø, autoimmune- eller genetiske faktorer.2.3
Miljø/autoimmune faktorer
- Alkohol
- Røyking
- Autoimmune sykdommer– idiopatisk
Arvelige/medfødte faktorer
- Hyperparatyridiodisme
- Hyperlipidemi
- Cystisk Fibrose
- Dårlig ernæring på grunn av redusert fordøyelse av protein
Alkohol er den mest vanlige miljøfaktoren, og står for 70-80% av tilfellene til Kronisk pankreatitt.3 Røyking har i nyere studier vist seg å være en vel så stor uavhengig risikofaktor.12 Røyking og alkohol sammen utgjør en betydelig risikofaktor.3
Hos voksne med kronisk pankreatitt er ca. 10% av tilfellene idiopatisk.3
PatofysiologiBetennelsen ved kronisk pankreatitt har flere patofysiologiske karakteristikker som:4
- Fibrose i pankreasvev
- Pankreatisk ductus dilatasjon
- Kalsifisering av pankreatisk ductus eller parenkyma
- Endokrin og eksokrin dysfunksjon
I tillegg vil ofte akutte betennelser, fettnekrose og pankreatisk pseudocyster være til stede.2
Destruksjon av pankreatisk ductus og acinære celler reduserer pankreas evne til å produsere fordøyelsesenzymene amylase, lipase og protease.13
Dette resulterer i malabsorpsjon og feilernæring.3,5
Når alkoholmisbruk er bakgrunnen for kronisk pankreatitt, vil symptomene på EPI komme etter 10-15 års misbruk.3
EPI har vist seg å være en uavhengig risikofaktor for tidligere død hos pasienter med kronisk pankreatitt.6
På tross av dårligere pankreasfunksjon ved EPI, kan karbohydrater og proteiner fordøyes til en viss grad.13 Dette da andre områder av GI trakten kompenserer for mangel på protease og amylase.6 Fett fordøyelsen derimot er mer komplisert, og lipase kan ikke bli kompensert for av andre enzymer.2
Fettfordøyelsen er spesielt rammet ved EPI:3
- Pankreas er hovedkilden for lipase som fordøyer fett.
- Pankreas evne til å skille ut lipase blir hemmet tidligere og i større grad enn de andre enzymene. Særlig hos pasienter med kronisk pankreatitt.
- Lipaseaktivitet i buken kan ikke kompensere for tap av lipaseproduksjon i pankreas. Ved EPI vil pankreas skille ut mindre bikarbonat som beskytter pankreasenzymer fra å bli denaturert
Ved EPI vil pankreas skille ut mindre bikarbonat som beskytter pankreasenzymer fra å bli denaturert av magesyre.13
- Lav pH deaktiverer gallesyrer, noe som reduserer oppløsningen av fett.13
- Pasienter med kronisk pankreatitt og EPI trenger pankreatisk enzymerstatningsbehandling (pankreatin) for å forbedre fordøyelsen og absorpsjon av næringsstoffer i maten4
Hos en frisk person står lipaseaktivitet i magen for 10% av fettfordøyelsen, men øker til mer enn 90% hos en person med EPI.3
SymptomerDet mest uttalte symptomet på kronisk pankreatitt og EPI er magesmerte og malabsorpsjon.2
Malabsorpsjon på grunn av EPI kommer sent i forløpet hos KP pasienter. Dette fordi symptomene på malabsorpsjon oppstår først når enzymene som produseres i pankreas er nede på under 10% av det som produseres i en frisk pankreas.2
EPI fører til malabsorpsjon og underernæring 2,7
som igjen fører til steatoré. Dette er fet, illeluktende avføring. Steatoré som er et av de mest uttalte symptomet ved EPI, kommer ofte ikke for langt ut i sykdomsforløpet.2,8
Steatoré er å finne hos ca 30% av pasientene med KP og fører til mangel på de fettløselige vitaminene, A, D, E og K, som igjen kan føre til osteoporose og andre komplikasjoner.2
Diabetes kan også være et sent symptom på kronisk pankreatitt fordi skade i eksokrin funksjon kan ledsages av den endokrine funksjonen. Dette er kjent som type 3c diabetes.14 Denne kjennetegnes av destruksjon av celler som utskiller insulin og celler som utskiller glugagon.2
KomplikasjonerKomplikasjoner fra malabsorpsjon og underernæring kan ha en negativ effekt på pasientens livskvalitet og kan påvirke underliggende lidelser samt påskynde morbiditet og mortalitet.9,10
Les mer om komplikasjoner ved EPI, se her.
DiagnoseEPI kommer sent i forløpet hos pasienter med kronisk pankreatitt. En enkel avføringstest (elastase1) kan avdekke dette sammen med billeddiagnostikk. Tidlig pankreatitt kan være en diagnostisk utfordring.2
Kronisk pankreatitt pasienter med magesmerte, diaré, ernæringsmangel og uønsket vekttap burde testes for EPI.2
Det er flere tilgjengelige metoder for diagnostisering av EPI men indirekte metoder er mest brukt i klinikken.
BehandlingErstatningsbehandling av pankreasenzymer (pankreatin) er standard behandling ved EPI.15
Hos pasienter med kronisk pankreatitt og samtidig EPI, har pankreatin vist gode effekter på fettabsorpsjon, avføringshyppighet, flatulens, magesmerte, BMI, og forbedring i livskvalitet.11
Studiedesign11En 51 ukes åpen oppfølgingsstudie av en en ukes multisenter, dobbelblind, randomisert, placebokontorlert studie gjort i India med 61 kronisk pankreatitt pasienter og EPI. Pasientene fikk pankreatin 80 000 IE pr måltid tre ganger pr dag samt pankreatin 40 000 IE pr mellommåltid (opp til tre ganger pr dag).
Etter 51 uker med pankreatinbehandling viste pasientene signifikant forbedring i a. avføringsfrekvens, b, kroppsvekt, og c, BMI.
Finn ut mer om behandling av EPI med pankratin, dosering av pankreatin, og andre aspekt av EPI behandling.
Referanser:
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl 6):vi1-28.
- Lindkvist B. Diagnosis and treatment of pancreatic exocrine insufficiency. World J Gastroenterol 2013;19(42):7258–7266.
- Suleiman SL, Kadiyala V, Conwell DL. Pancreatic exocrine insufficiency. Part 1 of 2: Pathogenic and Diagnostic Considerations. Gastroenterology and Endoscopy News, Special Edition, 2012. pp51-56. Available from: http://www.gastroendonews.com/download/Pancre_CaPart1GENSE12_WM.pdf. Last accessed: November 2017.
- Thorat V, Reddy N, Bhatia S, et al. Randomised clinical trial: the efficacy and safety of pancreatin enteric-coated minimicrospheres (Creon® 40000 MMS) in patients with pancreatic exocrine insufficiency due to chronic pancreatitis: a double-blind, placebo-controlled study. Aliment Pharmacol Ther. 2012;36(5):426-36.
- Imrie CW, Connett G, Hall RI, et al. Review article: enzyme supplementation in cystic fibrosis, chronic pancreatitis, pancreatic and periampullary cancer. Aliment Pharmacol Ther. 2010;32(Suppl 1):1-25.
- De la Iglesia-Garcia D, Vallejo-Senra N, Iglesias-Garcia J, et al. Increased Risk of Mortality Associated With Pancreatic Exocrine Insufficiency in Patients With Chronic Pancreatitis. J Clin Gastroenterol. 2017 Aug 30.
- Sikkens EC, Cahen DL, van Eijck C, Kuipers EJ, Bruno MJ. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Leeds JS, Oppong K, Sanders DS. The role of fecal elastase-1 in detecting exocrine pancreatic disease. Nat Rev Gastroenterol Hepatol. 2011;8:405-15.
- Ockenga J. Importance of nutritional management in diseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Fitzsimmons D, Kahl S, Butturini G, van Wyk M, Bornman P, Bassi C, Malfertheiner P, George SL, Johnson CD. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Ramesh H, Reddy N, Bhatia S, et al. A 51-week, open-label clinical trial in India to assess the efficacy and safety of pancreatin 40000 enteric-coated minimicrospheres in patients with pancreatic exocrine insufficiency due to chronic pancreatitis. Pancreatology. 2013;13(2):133-9.
- Trond Engjom, Anne Waage, Dag Hoem et al. Tidsskr Nor Legeforening, Utgave 3, 6. februar 2018
- Christina Brock, Lecia Møller Nielsen, Dina Lelic, Pathophysiology of chronic pancreatitis, World J Gastroenterol. 2013 Nov 14; 19(42): 7231–7240.
- Phil A Hart, Melena D Bellin , Dana K Andersen, Type 3c (pancreatogenic) diabetes mellitus secondary to chronic pancreatitis and pancreatic cancer, Lancet Gastroenterol Hepatol, 2016 Nov;1(3):226-237.
- Creon 10000, 25000, 35000 SPC punkt 4.1 (01.11.2021)
Bukspyttkjertelsvikt - Her er symptomene du må kjenne til

Det er stor variasjon i hvordan bukspyttkjertelsvikt presenterer, og det er grunn til å tro at det er underdiagnostisert. Slik kan du identifisere og behandle eksokrin pankreasinsuffisiens.
Artikkelen er skrevet av: Georg Dimcevski (f. 1966) professor, spesialist i indremedisin og i fordøyelsessykdommer.

Ettersom bukspyttkjertelen er et komplekst organ, kan mange symptomer og plager være relatert til dårlig funksjon i bukspyttkjertelen.
Mindre kjent er det at magesmerter ofte kan være et av de første tegnene på eksokrin pankreasinsuffsiens (EPI) - en tilstand der bukspyttkjertelen ikke produserer nok fordøyelsesenzymer til å fordøye maten.
Flertallet har smerter lokalisert dypt og sentralt i magen, med utstråling til flanke og rygg. Smertemønsteret kan variere: episoder med smerte, gradvis begynnelse av konstant smerte med smertefrie intervaller og kontinuerlig smerte med og uten forverringer. Smertene forverres etter måltid, og fører ofte til kvalme og oppkast.


Ved bukspyttkjertelsvikt resulterer sviktende sekresjon av enzymer og bikarbonat/væske fra bukspyttkjertelen etter måltidene i malabsorpsjon, altså manglende evne til å ta opp næringsmidler i tarmen.
Dette fører til vekttap og steatoré (illeluktende, klissete avføring). Dette opptrer gjerne sent i sykdomsforløpet, men kan også være til stede på diagnosetidspunktet. Med andre ord fører enzymmangel til en stor mengde ufordøyd mat, spesielt fett i avføringen, som også gir diare· og økt avføringsfrekvens samt oppblåsthet, utspilt mage, rumling og flatulens.
I tillegg fører enzymmangelen til mangel på fettløselige vitaminer (A, D, E og K), som kan sees i tidlig fase av eksokrin svikt.
Diabetes debuterer oftest sent i forløpet, med en forekomst på litt over 43 % i den nordiske populasjon, ved kjent kronisk bukspyttkjertelsvikt.
Der finnes også andre mindre kjente sekundære komplikasjoner til bukspyttkjertelsvikt. Fra bakteriell overvekst, gastroparese, opiatindusert tarmparalyse, avhengighetsproblematikk, magesår og andre tilstander som er assosiert med svikt i bukspyttkjertelen.2

Kronisk bukspyttkjertelsvikt/betennelse er sannsynligvis underdiagnostisert. Dette på grunn av en stor variasjon i presentasjonen - alt fra symptomfrihet til uttalte symptomer med betydelig forringelse av livskvaliteten.
Diagnosen kan være vanskelig å stille og sent legebesøk hos pasienter i risikosonen fører til at sykdommen i mange tilfeller ikke oppdages.

Ved overnevnte tegn og symptomer i mer enn 3-4 uker bør man utredes for å avdekke en eventuell ernæringssvikt. Diagnosen kan være svært vanskelig å stille, men en enkel avføringsprøve (fekal elastase-1 - se faktaboks) kan avdekke om fordøyelsesproblemene skyldes enzymmangel som kan behandles.

De fleste pasienter kan behandles med en kombinasjon av kostveiledning, tilskudd av bukspyttkjertelenzymer og god smertebehandling ved uttalte magesmerter.
Tilførsel av fordøyelsesenzymer vil sikre nødvendig fordøyelse av maten. Dette sikrer i sin tur adekvat inntak av fett, fettoppløselige vitaminer, mineraler samt proteiner og polysakkarider.
Enzymbehandling starter som oftest ved vekttap eller annen indikasjon på underernæring eller malabsorpsjon. Målet er å unngå ernæringssvikt og beinskjørhet (osteoporose). Behandlingen gis i form av kapsler som inneholder de tre viktigste enzymene (lipase, amylase og protease).
Doseringen oppgis etter lipaseinnhold og tilpasses grad av svikt, plager og fettinntak. Ved oppstart av enzymbehandling anbefales 50 000 enheter lipase for et hovedmåltid, som halveres til mindre måltider. Enzymer tas ved måltidets start. Dosene kan også dobles eller tredobles.
Ved manglende effekt eller behov for høye enzymdoser kan det gis syrehemmende medikamenter for å øke enzymenes effekt. Pankreasenzymer kan man få på blå resept hvis man har påvist lav elastase ved positiv fekal elastase-1 test.

Stikk motsatt av tidligere praksis er inntak av fettrik mat ikke anbefalt redusert. Spesielt ved underernæring og/eller steatoré er det spesielt viktig å tilpasse doseringen for å sikre vektoppgang og redusering av overflødig fett i avføring.
Ved bruk av næringstilskudd bør man velge formuleringer som absorberes lett. Kartlegging av kosthold og registrering av næringsinntak hos ernæringsfysiolog bør overveies. Tilskudd av kalsium, fettløselige vitaminer og B-vitaminer anbefales.
Til sist bør man også forsøke å fjerne eller redusere faktorer som påvirker sykdommen i negativ retning. Råd om redusert inntak av alkohol og røykestopp bør gis for å stoppe sykdommen i en tidlig fase og redusere plagene ved etablert sykdom.


Referanser:
- Norsk veileder for diagnostikk og behandling av kronisk pankreatitt, NGF-Nytt nr 4 - Desember 2016 https//gastroenterologen.no/ngf/pdf/2016-04-ngf-nytt.pdf
- Tidsskr Nor Legeforen, 5 februar 2018, Trond Engjom, Anne Waage, Dag Hoem et al https //tidsskriftet no/2018/02/klinisk-oversikt/kronisk-pankreatitt-utredning-og-behandling
NON-2023-6223
Pankreas cancer
Eksokrin pankreas insuffisiens hos pasienter med pankreas cancer kan oppstå på grunn av obstruksjon av pankreas ductus, destruksjon av pankreas på grunn tumorer, og/eller tap av vev som følge av kirurgi.1
Derfor kan utskillelsen av pankreasenzymer hemmes og det er vist sammenheng mellom ubehandlet alvorlig EPI og redusert overlevelsestid.2 Selv om det ikke er påvist EPI ved diagnosetidspunktet vil denne komme senere i sykdomsforløpet.3
Den årlige insidensen av pankreas cancer i vestlige land er estimert til 7,2 pr 100,000.3 Prevalensen av EPI i pasienter som er vist i studier, varierer fra 66 – 92%, med 65 - 75% av pasientene som opplever fettrelatert malabsorpsjon, samt at 50% opplever delvis proteinrelatert malabsorpsjon.1,2 Symptomer på grunn av EPI og malabsorpsjon kan være en betydelig faktor til redusert livskvalitet hos pasienter med pankreas cancer.3
Årsaker
Pasienter som har cancer i hodet på pankreas har høyest risiko for EPI, fordi denne ofte vil føre til obstruksjon i gallegang og pankreas ductus.3 Kreft i hodet av pankreas er mer forbundet med redusert pankreasfunksjon sammenlignet med kreft i kroppen eller halen av pankreas.2 Dette gjelder både den endokrine og den eksokrine funksjonen.1
I tilfeller av tumor obstruksjon, reduseres ikke den eksokrine sekresjonen før mer enn 60% av total ductus lengde er obstruert. Jo nærmere cancer er til duodenum, jo større er skaden på den eksokrine funksjonen.1
Patafysiologi
Blokkering av ductus pancreaticus er den vanligste årsaken til EPI ved pankreas cancer, og erstatning av pankreatisk parenkymalt vev med tumorvev forsterker problemet.3
Flere andre faktorer er medvirkende i patofysiologien ved pankreas cancer:3
- Tumor-avledede faktorer forårsaker metabolske abnormiteter som resulterer i økt glukoseproduksjon, økt proteinnedbrytning i hele kroppen og økt lipolyse.
- Protein- og fettlager tar slutt.
- Proinflammatoriske cytokiner som frigjøres i svulstens mikromiljø fremmer videre lipolyse, proteolyse og insulinresistens, og virker også sentralt for å forårsake anoreksi.
- Sekundære mekaniske faktorer kan forekomme som tarmobstruksjon, smerte, kvalme og oppkast
Noen pasienter gjennomgår palliativ kirurgi for omgå gallegang og mage, men dette kan resultere i at pankreasenzymer og galle frigjøres i tarmen på forsinket tidspunkt i forhold til chymus, noe som ytterligere forverrer symptomene på EPI.3
Produksjonen av flere fordøyelsesenzymer har vist seg å være redusert hos pasienter med pankreaskreft, inkludert:2
- Trypsin
- Lipase
- Amylase
- Elastase
Av disse er utskillelsen av elastase mest uttalt.2
Mønsteret for enzymsekresjon endres også, slik det fremgår av EPI, på grunn av kronisk pankreatitt:1
- Betydelig reduksjon i forholdet lipase / trypsin
- Betydelig reduksjon i forholdet lipase / fosfolipase
- Tap av det typiske sekretoriske mønsteret
Fakta
Pankreaskreft har lav overlevelse. Mindre enn 5% av pasientene lever 5 år etter diagnosen.
Kilde: Suleiman SL, et al. 20123
Symptomer
EPI kan være udiagnostisert da symptomene kan være lik andre gastrointestinale sykdommer.4
EPI fører til malabsorpsjon og feilernæring.3,5 Det mest uttalte symptomet er steatoré, og kommer ofte i en sen fase av sykdomsforløpet.2,3
Noen pasienter får ikke symptomer på steatoré fordi:
- Pasientene reduserer fettinntak.
- Opioder somtas for å lindre smerter fører til obstipasjon, og dekker over symptomer på steatoré.
Komplikasjoner
Komplikasjoner som følge feilernæring og malabsorpsjon vil ofte på sikt forverre pasientens velvære. Noe som kan påvirke utfallet av den underliggende sykdommen og øke sykelighet og dødelighet.6-8 Her kan du leser mer om dette Komplikasjoner på ved EPI.
Diagnostisering
Pasienter med pankreas cancer som har magesmerter, diaré, underernæring og uønsket vekttap bør testes for EPI.3 Det er flere metoder tilgjengelig for diagnostisering av EPI. Den mest brukte i klinikke er Elastase-1 test.
Behandling
Ca. 80% til 90% av pasientene med kreft i bukspyttkjertelen har inoperabel eller avansert metastatisk sykdom. Derfor er ofte formålet med behandlingen å lindre smerter, samt å forbedre symptomene, inkludert gastrointestinale- og diettproblemer.2
Tidlig behandling av EPI anbefales for å redusere symptomer og forbedre fettabsorpsjon, og vektøkning hos pasienter med kreft i bukspyttkjertelen.2, 3
Hos pasienter med EPI etter pankreaskreft, er pankreatin standardbehandling.2, 3
Kliniske studier har vist at pankreatin er effektiv og viktig for ernæringen, hos pasienter med uhelbredelig kreft i bukspyttkjertelen.
Dette fordi pankretain i placebokontrolerte studier har vist å bedre fettabsorpsjon hos pasienter med pankreaskreft og EPI.9
Pankreatin har også i studier vist økt overlevelse hos pasienter med pankreaskreft.10
Studier med pankreaskreft
I en retrospektiv analyse så man på overlevelse blant pasienter med pankreatisk ductal adenokarsinom (PDAC), ved bruk av Read og ICD-10-koding hos pasienter som var registrert mellom januar 1998 og september 2015. Man sammenlignet pasienter som hadde fått pankreatin med de som ikke hadde blitt behandlet for EPI. Totalt 807 PDAC-pasienter ble behandlet med pankreatin, og ble matchet med 807 ikke-pankreatin-behandlede PDAC-kontroller. Disse ble fulgt i gjennomsnitt 371,8 (median 193) dager.10
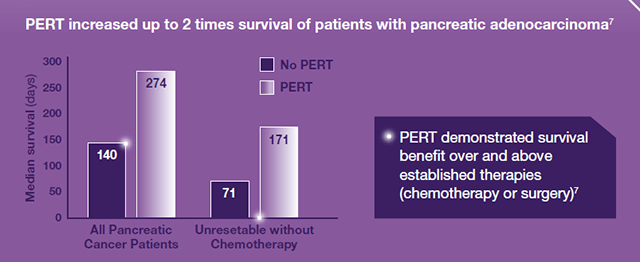
Basert på data fra Roberts K, Pancreatology 2019; 19:114-121 10
Ernæringsintervensjon (pankreatin, ernæringstilskudd eller henvisning til en diett) hos pasienter med EPI på grunn av pankreaskreft, var forbundet med forlenget overlevelse.10,11
Effekten av ernæringsintervensjon
Dette var en retrospektiv analyse av pasienter fra diagnose med oppfølging i inntil 1 år (pankreatisk adenokarsinom og nevroendokrine svulster). Målet var å vurdere forekomsten av EPI og effekten av ernæringsintervensjon på total overlevelse. Av de 183 pasientene som ble observert i analysen, hadde de fleste (83%) blitt henvist til palliativ cellegift, og 63% hadde symptomer på PEI. Av de 79 (43%) pasientene som fikk ernæringsintervensjon, fikk 93% pankreatin, 4% fikk kosttilskudd, og 4% ble henvist til ernæringsfysiolog.10
- Ernæringsintervensjon (pankreatin, ernæringstilskudd eller henvisning til ernæringsfysiolog) var en signifikant uavhengig faktor assosiert med lengre overlevelse (10,2 måneder kontra 6,9 måneder, p = 0,015)10
- Pasienter som fikk ernæringsbehandling hadde større toleranse for kjemoterapi (65,8% mot 50%; p = 0,03)10
Vurdering av pasienters næringsinntak av en ernæringsfysiolog, er en viktig del av EPI behandlingen hos pasienter med pankreas cancer.3
- Tilskudd av omega-3-fettsyrer i kosten bør vurderes hos pasienter med kreft i bukspyttkjertelen, da det kan undertrykke inflammatoriske prosesser involvert i kreftassosiert kakeksi.3
- EPI kan forårsake mangler i fettløselige vitaminer som A, D, E og K, så supplement av disse bør vurderes.3
Les mere om behandling av EPI, dosering av pankreatin, og andre aspekter av EPI behandling.
Referanser:
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl 6):vi1-28.
- Singh VK, Haupt ME, Geller DE, et al. Less common etiologies of exocrine pancreatic insufficiency. World J Gastroenterol. 2017;23(39):7059-7076.
- Miroslav Vujasinovic, Roberto Valente, Marco Del Chiaro, et al. Pancreatic Exocrine Insufficiency in Pancreatic Cancer. Nutrients. 2017 Mar; 9(3): 183.
- Leeds JS, Oppong K, Sanders DS. The role of fecal elastase-1 in detecting exocrine pancreatic disease. Nat Rev Gastroenterol Hepatol. 2011;8:405-15.
- Sikkens EC, Cahen DL, de Wit J, et al. A prospective assessment of the natural course of the exocrine pancreatic function in patients with a pancreatic head tumor. J Clin Gastroenterol. 2014;48(5):e43-6.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Ockenga J. Importance of nutritional management indiseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Fitzsimmons D, Kahl S, Butturini G, van Wyk M, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Bruno MJ, Haverkort EB, Tijssen GP, et al. Placebo controlled trial of enteric coated pancreatin microsphere treatment in patients with unresectable cancer of the pancreatic head region. Gut. 1998;42(1):92-96.
- Roberts KJ, Bannister CA, Schrem H. Enzyme replace therapy improves the survival rate of patients with pancreatic cancer – results of a population based study. Pancreatology. 2019; 19: 114-121.
- McCallum L, Lamarca A, Valle JW. Prevalence of symptomatic pancreatic exocrine insufficiency in patients with pancreatic malignancy: nutritional intervention may improve survival. Cancer Research Frontiers. 2016;2(3):352-367.
EPI og cystisk fibrose
Cystisk fibrose er en autosomal irreversibel genetisk sykdom som skader utskillelsen av salt og bikarbonat fra epitelceller i mange deler av kroppen.1 Dette påvirker væskenivået i epitelceller og gir mange kliniske symptomer med særlig skade i respirasjon og ernæringssystemet.1 Fra pankreas blir sekresjonen seigt, tyktflytende og får et høyt saltinnhold.2 Dette blokkerer frigjøring av enzymer og fører til eksokrin pankreas insuffisiens (EPI).2,3 Selv om behandlingen de siste årene stadig har gjort framskritt så er fortsatt cystisk fibrose forbundet med tidligere død.1
Cystisk fibrose rammer ca.1 av 2500-3000 fødsler.2 Man har i dag screening for cystisk fibrose ved fødselen i Norge, så de fleste blir diagnostisert da.9
55-100% av pasienter med cystisk fibrose har i noen grad EPI,2 og 85-95% har EPI der man har fått diagnosen før fylte 1 år. 80% av pasientene med cystisk fibrose har alvorlig EPI.3
Årsaker
Ved cystisk fibrose vil seigt sekret fra pankreas fører til obstruksjon i pankreas ductus og EPI.1 Den stadige reduksjonen av pankreasenzymer og bikarbonat i tarmen fører til malabsorpsjon av fett og proteiner.
Disse forverres av nedsatt gastrointestinal motilitet og økt magesyresekresjon.1 I tillegg reduseres bikarbonatsekresjonen fra bukspyttkjertelen, noe som kan forårsake forsinket gastrisk tømming og gastroøsofageal refluks.4
Ductal obstruksjon er også assosiert med utvikling av symptomatisk akutt pankreatitt hos noen få pasienter med cystisk fibrose.1
Patofysiologi
Cystisk fibrose forårsakes av mutasjoner i gen på kromosom 7. Dette CFTR-genet styrer koder for CFTR-proteinet (Cystic Fibrosis Transmembrane Regulator).9 Proteinet er en ionekanal, en mikroskopisk kanal i cellemembranen. Proteinets oppgave er å transportere klorid og natrium ut av celler på overflaten av blant annet slimhinner i luftveiene, i svettekjertlene og i pankreas (epitelcellene).2,4
Svekkelse av cellulær klorid transport påvirker intracellulært væskenivå og har den effekten at det reduserer volumet og øker viskositeten til de eksokrine sekresjonene i bukspyttkjertelen.1 Dette fører til obstruksjon av bukspyttkjertelkanalene, ødeleggelse av acinære celler, fibrose og EPI.4
Den økte viskositeten og saltinnhold er til stede i mange organer i tillegg til pankreas, inkludert lungene, noe som gir andre symptomer på luftveisinfeksjon med bronkiektasi.2 Sjansen for å utvikle EPI for pasienter med cystisk fibrose avhenger av genmutasjonene pasientene har.3 Generelt har de aller fleste to alvorlige genmutasjoner og utvikler så EPI.1 Omtrent 10% av pasientene med cystisk fibrose er bærer av en mild mutasjon, og viser derfor ikke symptomer på EPI, og har normal vekst.1 Disse kan likevel utvikle EPI i voksenlivet.3
Fakta
Pankreatin forbedrer fordøyelsen og absorpsjonen av næringsstoffene.3,4 Men likevel har studier vist at 19% av barna med EPI og cystisk fibrose er under den minste persentilen for vekt.3,4 Dette muligens på grunn av endringer i gastrointestinal pH, motilitet og transitt som svekker næringsopptaket.3,4
Symptomer
EPI fører generelt til malabsorpsjon og dårlig fordøyelse.2,5 For noen spedbarn med cystisk fibrose kan amylase og lipase i morsmelk kompensere for EPI.4 I så fall kan de få vekttap etter ammeperioden er over. Eldre barn kan kompensere for manglende opptak av næringsstoffer ved økt matinntak på grunn av økt appetitt. Men på grunn av infeksjoner som følger sykdommen, kan de oppleve vekttap på grunn av redusert næringsopptak.4
En liten andel pasienter med cystisk fibrose (<10-20%) som er homozygote eller heterozygote for de mindre alvorlige mutasjonene, kan ha normal pankreas-funksjon og vekst gjennom barndommen.4 Disse kan likevel utvikle symptomer på EPI i voksen alder, sammen med tilfeller av pankreatitt.4
Steatoré er preget av illeluktende, fettete avføring, og er vanligvis den vanligste kliniske manifestasjonen av EPI.5 Steatoré kan etterfølges av mangel på fettløselige vitaminer: A, D, E og K, noe som fører til osteoporose og andre komplikasjoner.3
Komplikasjoner
Komplikasjoner fra malabsorpsjon kan ha progredierende negativ effekt på pasientens helse.4,6,7 For mer informasjon om dette temaet, les her om komplikasjoner ved EPI
Diagnostisering
Det er flere metoder for å diagnostisere EPI. Elastase-1 test som er en indirekte test, er den mest brukte i klinikk.1 Måling av fett i feces er en mer nøyaktig metode, men brukes mest i studiesammenheng, da den krever oppsamling av all avføring 3-5 dager på én uke. I tillegg fins det direkte metoder som er mer nøyaktig, som man tar dersom man er i tvil om svaret, etter å ha tatt Elastase-1 test.1
Spedbarn som er diagnostisert med cystisk fibrose, bør måle vekt og høyde månedlig, deretter hver 2-3 måned. Indirekte tester for EPI bør utføres hver 4-6 måned.
Man bør teste oftere hvis pasienten med cystisk fibrose ikke oppnår forventet vektoppgang eller har symptomer forbundet med EPI som steatoré.2 Minste anbefalte hyppighet av vekst mål hos pasienter med cystisk fibrose.2

Kilde: Stapelton et al. 2006.2
* Ukentlig om klinikkbesøk er hyppigere.
† Hvis vekst har stoppet, hvis ikke hver 3. måned inntil vekst stopper (Husk at vekst hos gutter med CF kan vare til man er 20 år)
% IBW: Prosent av idealvekt
Kilde: APC Guidelines, 2015.
Behandling
Behandling av EPI hos pasienter med cystisk fibrose
Manglende behandling av EPI av pasienter med cystisk fibrose kan føre til:4
- Redusert vekst
- Forsinket pubertet
- Forverret lungefunksjon
- Respirasjonssvikt
- Tidligere død
Pankreas enzymerstatningsbehandling (pankreatin) er grunnbehandling hos pasienter med EPI og cystisk fibrose.9,11 Dette for å motvirke malabsorpsjon og underernæring, redusere steatoré, og oppnå vanlig vekst.4
Pankretaindose ved cystisk fibrose kan variere fra individ til individ, men for barn og voksne er 500-3000 IE pr kg kroppsvekt anbefalt til et måltid.4 Alternativt kan 2000-4000 IE gis ved hver amming til spedbarn eller 120 ml morsmelkerstating.2 Maksdose skal ikke overstige 10 000 lipaseenheter pr kg kroppsvekt pr dag.2
For barn i skolealder kan det oppleves stigmatiserende å måtte ta en stor mengde kapsler til hvert måltid. Dette kan føre til dårligere compliance med negative følger for vekst og vekt. Konsekvenser av dette bør derfor man derfor motvirke med å ta dette opp med pasienter og foreldre.4
Doser kan titreres basert på vektoppgang og tarmsymptomer for å finne laveste effektive dose. Symptomer på malabsorpsjon som magesmerte, flatulens, og avføringskonsistens er ikke indikasjoner for dosejustering.2
I tillegg til pankreatin bør tilskudd av fettløselige vitaminer A ,D, E og K gis profylaktisk.2
Langtidsbehandling og monitonering for EPI hos pasienter med cystisk fibrose.2
Barn bør vurderes med jevne mellomrom for høyde, vekt og hodeomkrets, diettinntak, biokjemiske vurderinger og en gjennomgang av tarmfunksjon. Hos veldig små barn, bør matinntak vurderes hyppigere.9
Voksne kan miste vekt på grunn av aldring, osteoporose eller kyfose. En gjennomgang av diettinntak bør gjøres minst én gang i året.9
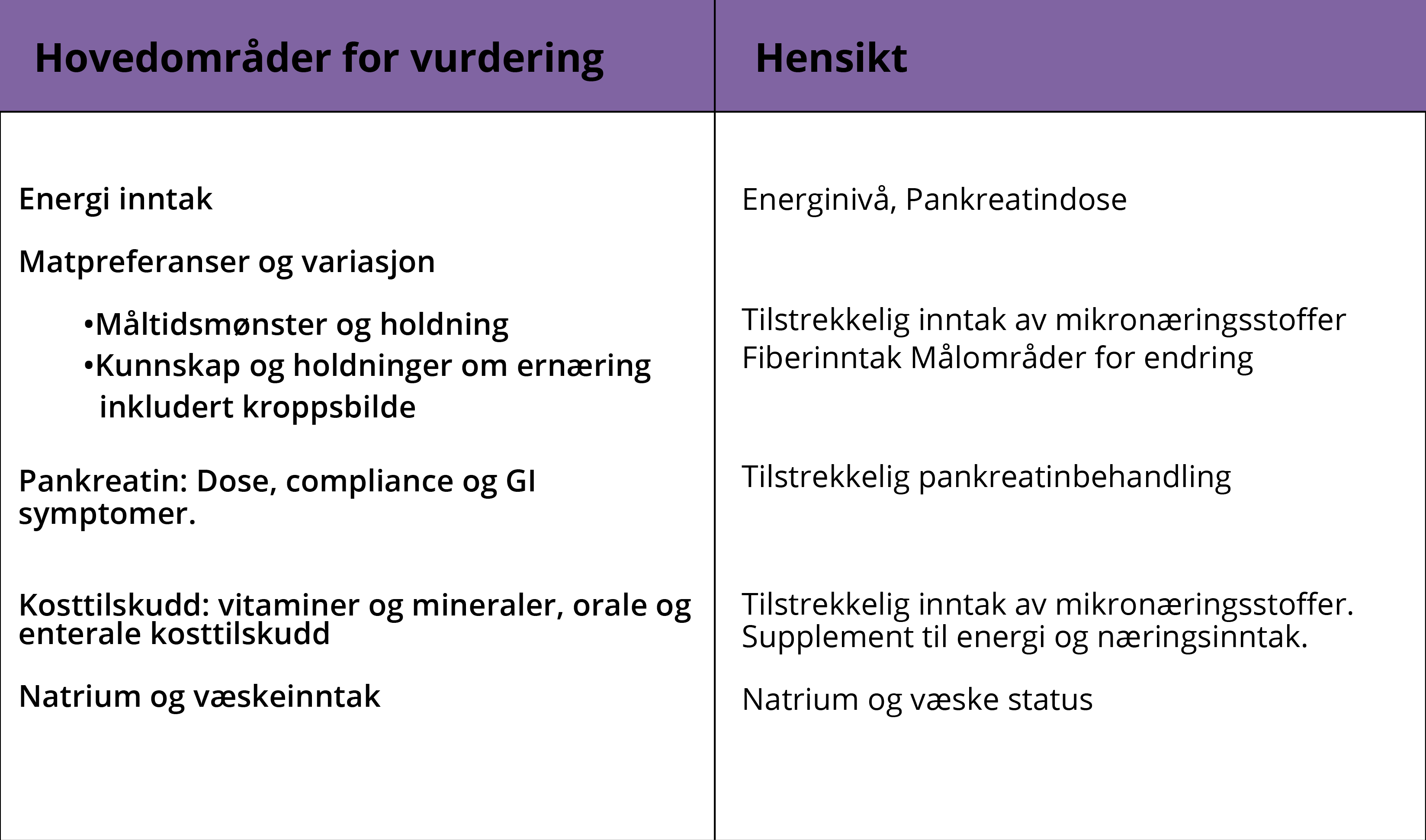
Områder for ernæringsvurdering for pasienter med cystisk fibrose:
Referanser:
- Katherine N. Gibson-Corley,1 David K. Meyerholz, John F. Engelhardt, Pancreatic Pathophysiology in Cystic Fibrosis, J Pathol. 2016 Jan; 238(2): 311–320.
- Blanka Klimova, Kamil Kuca , Michal Novotny, et al. Cystic Fibrosis Revisited - a Review Study. Med Chem 2017;13(2):102-109.
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl 6):vi1-28.
- Imrie CW, Connett G, Hall RI, et al. Review article: enzyme supplementation in cystic fibrosis, chronic pancreatitis, pancreatic and periampullary cancer. Aliment Pharmacol Ther. 2010;32(Suppl 1):1-25.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Domínguez-¬Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12-16.
- Ockenga J. Importance of nutritional management in diseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Fitzsimmons D, Kahl S, Butturini G, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- PediatriveiledereFra Norsk barnelegeforening. 7.14 Cystisk fibrose, Revidert 2018
- Kris De Boeck, Matijn Weren, Marijka Proesmans etak, Pancreatitis Among Patients With Cystic Fibrosis: Correlation With Pancreatic Status and Genotype, Pediatrics April 2005, 115 (4) e463-e469;
- Creon 10000, 20000, 35000 SPC punkt 4.1 (01.11.2021)
Pankreaskirurgi og EPI
Pankreaskirurgi er blitt en vanlig behandling av begning eller malign pankreassykdom. EPI oppstår hyppig hos pasienter etter pankreaskirurgi. Alvorlighetsgraden av EPI avhenger av type kirurgi og graden av parenkym reseksjon. Pankreatisk enzym erstatning (pankreatin) er førstelinjebehandling etter pankreaskirurgi.
Pankreas kirurgi - delvis eller total- er vanlig etter pankreas kreft eller ved kronisk pankreatitt. Dette fordi det gir økt overlevelse etter kreft i bukspyttkjertelen, og i noen tilfeller kan øke sjansen for helbredelse. Nyere utvikling av organ bevarende prosedyrer har ført til økt bruk av kirurgi ved kronisk pankreatitt, og andre mindre vanlige godartede pankreas sykdommer.1,3
Selv om bukspyttkjertelkirurgi forbedrer sykdomsprognosen, er det en veldig inngripende operasjon. Dette fordi den fører til postoperative komplikasjoner, og fordi den fører til en betydelig logistisk belastning på helsevesenet. Som regel bevares noe bukspyttkjertelvev for å opprettholde en viss eksokrin funksjon. Likevel vil det ofte medføre eksokrin pankreas insuffisiens EPI, spesielt hos de som har gjennomgått total pankreatomi og som ikke har noen pankreasfunksjon.1,2
Epidemiologi for EPI etter pankreaskirurgi
Ca. 80 % av pasientene vil få eksokrin insuffisiens etter pankreaskirurgi.4 Eksokrin funksjon bedømmes etter operasjon i pankreas og vil variere i lys av den underliggende sykdom og den kirurgiske prosedyren. Postoperativ EPI er vist hos 65% –80% av pasientene med kronisk pankreatitt (CP), og hos 80% av pasientene med kreft i bukspyttkjertelen.5
Hvordan pankreas kirurgi fører til EPI
Pankreaskirurgi forårsaker anatomiske endringer i bukspyttkjertelen, samtidig som det er vanlig med endringer i nærliggende organer (inkludert galleblæren, gallegangen og tolvfingertarmen), noe som fører til EPI. Omfanget av bukspyttkjertelreseksjonen er en viktig faktor for utviklingen av EPI - jo større reduksjon i bukspyttkjertelens parenkym, jo større er sannsynligheten for å utvikle EPI.5 Ved kirurgi etter Whipples prosedyre, endres normal fordøyelsesfysiologi. Dette kan resultere i unormal frigjøring av post-prandial kolecystokinin (CCK), og det fører til redusert eksokrin bukspyttkjertelsekresjon. Bukspyttkjertelkirurgi vil også ofte forårsake asynkroni mellom tømming av chymus fra magesekken og bukspyttkjertelsekresjon i tynntarmen, noe som fører til utilstrekkelig mengde av enzymer for å fordøye chymus når den passerer duodenum. Dette fenomenet kalles sekundær eksokrin insuffisiens.5
Pankreaskirurgi kan også forårsake endringer i PH i magesekken i magesekken og duodenum, noe som kan påvirke denatureringen av pankreasenzymer, og dermed redusere enzymaktiviteten. Videre kan bukspyttkjertelkirurgi, spesielt Roux-en-Y-anastomose eller kirurgi i duodeum, kan også forårsake bakteriell overvekst på grunn av mangel på magesyre og endret tarmmotilitet. Dette er en vanlig årsak til underernæring etter bukspyttkjertelkirurgi.5
Faktorer som påvirker alvorlighetsgraden av EPI etter pankreaskirurgi
Alvorlighetsgraden av EPI avhenger av hvilken type kirurgisk prosedyre som brukes og omfanget av parenkymal reseksjon. Videre påvirker statusen for eksokrin funksjon i bukspyttkjertelen også graden av EPI. Nedenfor er en kort beskrivelse av disse faktorene:3 Grad av parenkym reseksjon: 30-50% reseksjon i en ellers normal bukspyttkjertel vil normalt ikke forårsake klinisk EPI. Men i noen tilfeller kan også et mindre tap av pankreas parenkym føre til EPI. Dette som følge av en skadet bukspyttkjertel, som ved pankreasatrofi, betennelse eller ductal obstruksjon.3
Typer kirurgisk reseksjon:
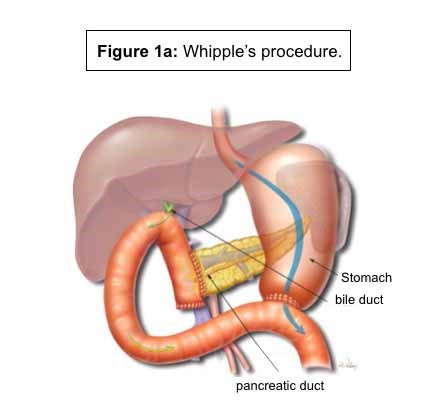
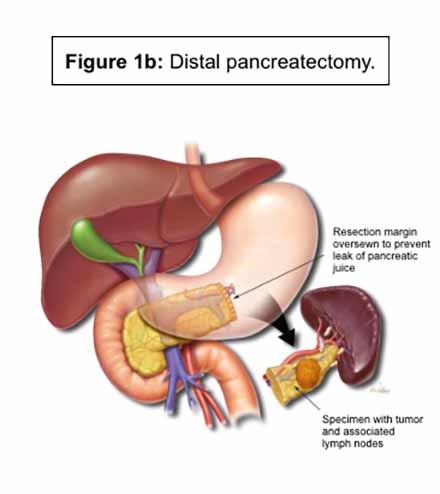
Duodenektomi eller Whipple's metode: Den vanligste bukspyttkjertelreseksjonen er duodenektomi eller Whipple's metode.9 Det utføres vanligvis for svulster som forårsaker obstruksjon i bukspyttkjertelen, som forårsaker varierende grad av EPI og endokrin insuffisiens.3 Dette innebærer reseksjon av bukspyttkjertelen, galleblæren, gallegang og duodenum. Bukspyttkjertelen, gallegangen og magen kobles deretter til tynntarmen igjen.9 Dette gjenoppretter strømmen av sekresjon fra pankreas, galle fra gallegangen og chymus fra magen - og gjenoppretter dermed fordøyelsesfunksjonen (figur 1a).9 Studier rapporterer en høyere grad av EPI ved Whipples metode sammenlignet med distal pankreatektomi (DP).
Distal pankreatektomi: Flertallet av pasientene har normal pankreas ductus i hodet og kroppen til pankreas etter DP og derfor relativt normal parenkym.9 (figur 1b). Som et resultat dette er det mindre sannsynlighet for EPI etter distal pankreatektomi.3
Sentral pankreatektomi: Dette utføres ved godartede svulster for å bevare eksokrin og endokrin funksjon i bukspyttkjertelen. Pasienter med sentral pankreatektomi kan utvikle EPI, avhengig av omfanget av reseksjonen.9
Total eller subtotal pankreatektomi: Det innebærer reseksjon av 90% –95% av parenkymet, og etterlater bare en liten del av bukspyttkjertelen.9 Dette fører til at EPI for denne gruppen.3
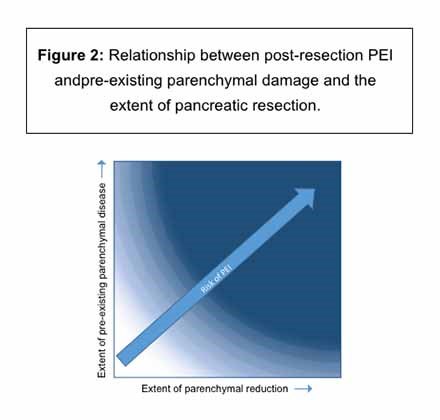
Eksisterende EPI før reseksjon i bukspyttkjertelen: Pasienter med EPI før parenkym reseksjon vil ha større sannsynlighet for vedvarende eller forverring av EPI etter reseksjon, bortsett fra i noen sjeldne tilfeller der obstruksjon i bukspyttkjertelen blir lindret ved reseksjon.3 Figur 2 viser forholdet mellom EPI etter reseksjon og eksisterende parenkymskade og omfanget av pankreasreseksjon.
Symptomer ved EPI
Symptomene på EPI er ofte like de vi ser ved andre gastrointestinale sykdommer, noe som kan føre til at sykdommen ikke blir diagnostisert. Eksokrin pankresinsuffisiens forårsaker malabsorpsjon og dårlig fordøyelse, noe som resulterer i forskjellige kliniske symptomer. Dette kan også ha en negativ effekt på den underliggende sykdommen, og øke total sykelighet og dødelighet.6,8 Les videre om komplikasjoner ved EPI i artikkelen komplikasjoner ved EPI.
Hvem skal diagnostiseres for EPI etter pankreaskiurgi?3
Pasienter som har EPI før kirurgi har større sannsynlighet for å forverre EPI etter operasjon, Unntaket er noen sjeldne tilfeller der obstruksjon i ductus kan forbedres etter kirurgi.3
- Pasienter som har normal parenkym (<50% reseksjon av bukspyttkjertelen), trenger kanskje ikke å diagnostieres dersom de ikke har symptomer.3
- Pasienter som har parenkymal atrofi eller betennelse med pankreasreseksjon vil normalt diagnostiseres for EPI-testing, selv i fravær av kliniske symptomer.3
- Et betydelig antall pasienter utvikler anastomotisk strikturer i pankreas ductus etter, Whipples operasjon eller sentral pankreatektomi. Disse pasientene kan utvikle EPI senere.3
Behandling av EPI etter pankreaskirurgi
Erstatning av pankreas enzymer (pankreatin) er avhengig av etiologi standardbehandlingen ved EPI. Målet er å identifisere de som trenger erstatning av enzym tidlig, da symptomene på EPI ofte ikke blir tydelige før lenger ut i sykdomsforløpet.3
Når EPI blir tidlig identifisert og behandlet med pankreatin, er dette med å redusere følger av underernæring, samt at den bidrar til at pasienten opprettholder kroppsvekt og forbedrer den generelle livskvaliteten.
Siden omfanget av EPI varierer mellom pasienter, bør doseringen av pankreatin settes individuelt (figur 3). Syrenøytraliserende behandling anbefales som tilleggsbehandling, særlig dersom man har steatoré etter oppstart med pankreatin.3,4
Figur 3: Terapeutisk algoritme for EPI hos pasienter etter pankreaskirurgi.
FFQ: Kvantifiseritifisering av fekal fett ; C13 ”mixed triglycerid breath-test”(MTB); U: enheter; PPI: Protonpumpehemmere
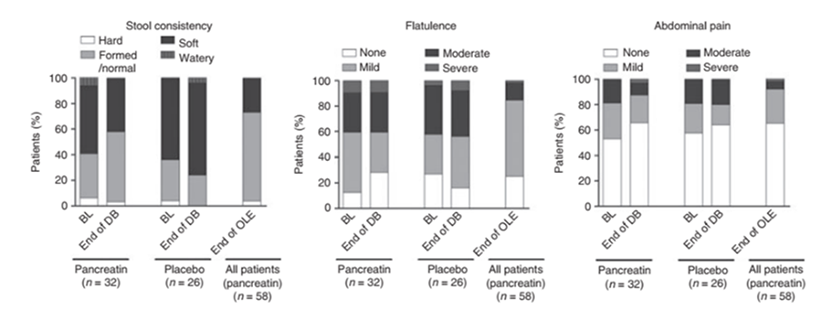
Klinisk studier hos pasienter etter pankreatektomi har vist effekt av høydose lipase (75.000 enheter per måltid og 50.000 enheter per mellommåltid) i behandlingen av EPI. Studieresultatene bekreftet effekten av Pankreatin, med økt koeffisient for fettabsorpsjon (CFA) i den behandlede gruppen sammenlignet med en reduksjon i placebogruppen. Det man så etter et års behandling var en signifikant økning i kroppsvekt og BMI fra baseline og en signifikant reduksjon i daglig avføringsfrekvens og avføringsvekt (Figur 4)1
- Studier har vist at de fleste pasienter som utvikler EPI etter bukspyttkjertelkirurgi er underbehandlet. Det er derfor viktig med oppfølging av pasienten for å justere dosen av pankreatin i forhold til symptomer og kosthold.5
- Viktig å huske:3,5
- Alvorlige pankreasreseksjoner skader ikke bare bukspyttkjertelfunksjonen, men også funksjonen til hele øvre mage-tarmkanal. Dette kan føre til EPI som påvirker ernæringsstatusen og livskvaliteten negativt.
- Pankreatin-tilskudd bør vurderes hos alle pasienter med påvist EPI, uavhengig av etiologi.
- Hos pasienter som har gjennomgått bukspyttkjertelkirurgi, kan pankratin være indisert selv ved asymptomatisk EPI, fordi studier har vist at underernæring kan utvikle seg hos disse pasientene.
- Videre kan pankreatin også være effektivt hos pasienter med kliniske tegn på malabsorpsjon uten påvist EPI, fordi disse kan ha sekundær eksokrin insuffisiens.3,5
Referanser:
- Seiler CM, Izbicki J, Varga-Szabo L, et al.Randomised clinical trial: A1-week, double-blind, placebo-controlled study of pancreatin 25 000 Ph. Eur. minimicrospheres (Creon 25000 MMS) for pancreatic exocrine insufficiency after pancreatic surgery, with a 1-year open-label extension. Aliment PharmacolTher.2013;37:691–702.
- Ho CK, Kleeff J, Friess H, et al. Complications of pancreatic surgery. HPB (Oxford). 2005;7(2):99–108.
- Adarsh Chaudhary,a,* J. Enrique Domínguez-ñoz,b Peter Layer, et al. Pancreatic Exocrine Insufficiency as a Complication of Gastrointestinal Surgery and the Impact of Pancreatic Enzyme Replacement Therapy. Digestive Diseases. 2020 Jan; 38(1): 53–68.
- Domínguez-Muñoz JE. Pancreatic enzyme replacement therapy: Exocrine pancreatic insufficiency after gastrointestinal surgery. HPB (Oxford). 2009;11(3):3–6.
- Sikkens ECM, Cahen DL, van Eijck C, et al. The daily practice of pancreatic enzyme replacement therapy after pancreatic surgery: a Northern European Survey:Enzyme Replacement After Surgery.JGastrointest Surg. 2012;16(8):1487–1492.
- Tignor AS, Wu BU, Whitlock TL, et al. High prevalence of low-trauma fracture in chronic pancreatitis. Am J Gastroenterol. 2010;105(12):2680–2686.
- Shintakuya R, Uemura K, Murakami Y, et al. Sarcopenia is closely associated with pancreatic exocrine insufficiency in patients with pancreatic disease. Pancreatology. 2017;17(1):70–75.
- De la Iglesia-Garcia, Vallejo-Senra N, Lopez-Lopez A, et al. Effect of pancreatic exocrine and endocrine insufficiency in cardiovascular events in patients with chronic pancreatitis (CP). A prospective cohort study.Pancreatology. 2018;(18):1–188.
- Sheraz Yaqub, Kim Erlend Mortensen, Kirurgen. 15. mars 2019.
EPI etter gastrokirurgi
Eksokrin pankreas insuffisiens (EPI) og underernæring oppstår hos ca. 80% etter gastrokirurgi.4 Tidlig diagnose av dårlig fordøyelse er viktig etter gastrisk kirurgi for å evaluere behovet for å behandle EPI (PERT).
Pankreasenzymer anbefales etter gastrokirurgi hos pasienter med tydelig steatoré, vekttap eller symptomer på malabsorpsjon.1
Gastrokirugi, enten delvis eller total gastrektomi, utføres ofte for å behandle magekreft, blødende magesår, polypper og perforeringer i mageveggen.1 Underernæring som en konsekvens av malabsorpsjon er en vanlig komplikasjon etter mageoperasjoner. Postoperativ dårlig fordøyelse er assosiert med EPI og forekommer uavhengig av hvilken type kirurgisk prosedyre som brukes.1
Selv om årsakene og underliggende mekanismer for EPI etter gastrokirurgi er noe ukjent, tyder studier på en tett funksjonell interaksjon mellom mage og bukspyttkjertel.1 Den betydelige eksokrine pankreastrofismen som oppstår etter gastrektomi antas å øke amylase og trypsin og redusere lipase i bukspyttkjertelen.1
Videre forårsaker både delvis og total gastrektomi post-cibal asynkroni mellom gastrisk tømming og utslipp av galle- og bukspyttkjertelenzymer i tynntarmen.1 Denne forstyrrede koordinasjonen mellom sekretoriske og motoriske funksjoner fører til redusert endogen stimulering av bukspyttkjertelen, noe som resulterer i reduserte intraluminale pankreasenzymer; utilstrekkelig interaksjon mellom pankreasvæsker og næringsstoffene i kymus; samt redusert kontakttid for fordøyelsen av næringsstoffer - alt dette fører til underernæring.
Andre mulige foreslåtte mekanismer inkluderer redusert gastrin, økt kolecystokinin, redusert sen postprandial bukspyttkjertelpolypeptid og denervering av bukspyttkjertelen.1
Nyere studier viser også økt forekomst av postoperativ EPI etter fedmekirurgi; Men disse symptomene på EPI er ofte sammenfallende med følgene av gastrisk bypass, noe som gjør en diagnose vanskelig.2
Gastrokirurgi svekker både eksokrin og endokrin funksjon i bukspyttkjertelen - noe som fører til primær og sekundær EPI. Omtrent 70% av pasientene som gjennomgår delvis gastrektomi og nesten alle pasienter som gjennomgår total gastrektomi, utvikler EPI etter operasjon.1
Symptomer på EPI etter gastrokirurgi inkluderer steatoré, vekttap, dårlig fordøyelse og malabsorpsjon.1,2
Diagnostisering av EPI etter gastrokirurgi
Diagnose av EPI etter gastrokirurgi stilles vanligvis på grunnlag av symptomer og vurderingen av pankreasfunksjonen. Den mest brukte testen i Norge for dette er Elastase 1 test, da den er mindre inngripende for pasienten.3
Utvidet pankreas funksjonstesting anvendes der det er tvil om førstelinjetesten. Tilgjengelige tester er endoskopisk sekretintest, c13-blandet triglyserid-pusteprøve og sekretin-MR.3
Behandling av EPI etter gastrokirurgi
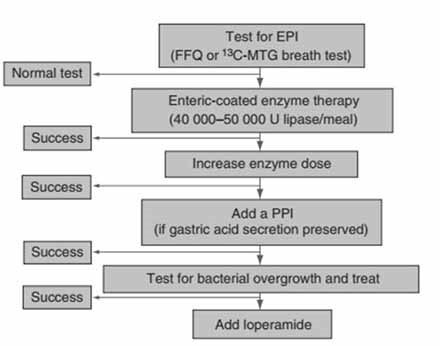
Figur 1. Algorytme for EPI behandling etter gastrokirurgi.
Pankreatin er standardbehandling for EPI, uavhengig av underliggende sykdom. Behandlingsmål ved EPI er å hindre malaborspsjon og underernæring, Pankreatin bør derfor taes sammen med måltid, slik at enzyme aktiviteten i duodenum er tilstrekkelig for å gjennoprette fordøyelsen.1
Se behandlingsalgorytme for behandling av EPI etter gastrokirurgi i figur 1.4
FIGUR 1
- Pankreatin i kombinasjon med en tilpasset diett med høyt energiinnhol fordelt på seks til åtte måltider per dag kan forbedre postoperativ ernæringsstatus og symptomer hos pasienter etter gastriokirurgi.1
- Den anbefalte dosen Pankreatin er 40 000–50 000 IE lipase per hovedmåltid og 25 000 IE lipase med små måltider eller mellommåltider. Imidlertid bør Pankreatin-dosene justeres individuelt basert på alvorlighetsgraden av sykdommen.5
- Det er ingen andre doseringsregimer for pasienter etter gastrokirurgi; Pankreatindosene bør justeres individuelt. Det ingen lineær sammenheng mellom Pankreatindosen og symptomene på dårlig fordøyelse.1
- Hvis steatoré ikke forbedres med foreskrevet Pankreatin-dosering, bør pasienter utredes videre for å om det er interaksjoner med andre foreskrevne medisiner.5
- Pasienter på Pankreatin bør følges opp regelmessig; Hvis symptomer ikke forbedres med Pankratin bør seponering av behandlingen vurderes. Hvis pasienter opplever symptombedring og bedring av livskvalitet, bør behandlingen fortsettes.5
Tilleggsbehandling
Hovedmålet med pankreatinbehandlingen er å gjenopprette lipaseaktiviteten i tynntarmen. Lipase, blir ofte inaktivert av magesyre og proteaser. Etter total gastrektomi har du ingen produksjon av magesyre, men etter delvis gastrektomi kan du fortsatt skille ut en viss mengde magesyre. Da bør syredempende legemidler som H2-antagonister og protonpumpehemmere vurderes som tilleggsbehandlinger hos disse pasientene.1
Andre ernæringsmangler assosiert med gastrektomi
Magen har en viktig rolle i forhold til B12-absorpsjon i terminal ileum. Derfor vil delvis gastrektomi redusere denne funksjonen og ved total gastrektomi vil den fullstendig opphøre , og forårsake vitamin B12-mangel. I tillegg oppstår jernmangel ved «duodenumbypass». I tillegg til Pankreatin må pasienter etter gastrokirurgi / gastrektomi behandlies vitamin B12 og jernrilskudd.1
Vurderinger før Pankreatinbehandling
Malabsorpsjon er en vanlig hos de fleste pasienter etter gastrisk kirurgi. Dette kan skyldes flere, komplekse faktorer som må undersøkes før du behandling med pankretin. Her er noen av disse faktorene:6
- Symptomene på malabsorpsjon kan skyldes bakteriell gjengroing i tynntarmen (SIBO). Dette er vanlig etter gastrokirurgi, og er et resultat av mangel på magesyre. Bakteriell gjengroing svekker tarmabsorpsjonen, noe som resulterer i steatoré.1 Dette kan behandles med riktig bruk av antibiotika.6
- Operasjoner, som for eksempel Polya (gastrojejunal) eller Roux-en-Y-anastomose, som medfører bypass av duodenum, kan føre til forstyrret synkroniseringen mellom bukspyttkjertelsekresjoner og kymuspassasje.6
- Ved noen typer gastrokirurgi fjerner man en stor del av magesekken. I disse tilfellene går maten raskere enn normalt inn i tynntarmen, og Pankreatin-kapselen kan passere i tynntarmen uten å bli ordentlig blandet med mat.6
Hos noen pasienter kan gastrisk tømming bli så treg at enzymene blir utsatt for magesyre og dermed inaktiverte.6
Referanser:
- Adarsh Chaudhary, J. Enrique Domínguez-Muñoz, Peter Layer et al, Pancreatic Exocrine Insufficiency as a Complication of Gastrointestinal Surgery and the Impact of Pancreatic Enzyme Replacement Therapy, Digestive diseases, 2020;38:53–68, 16.08.2019
- Vujasinovic M, Valente R, Thorell A, et al. Pancreatic exocrine insufficiency after bariatric surgery. Nutrients. 2017;9:1241–1248.
- Trond Engjom, Anne Waage, Dag Hoem, et al, Kronisk pankreatitt – utredning og behandling, Tidsskrift for Den norske legeforening, Februar 2018
- Domínguez-Muñoz JE. Pancreatic enzyme replacement therapy: Exocrine pancreatic insufficiency after gastrointestinal surgery. HPB (Oxford). 2009;11(3):3–6.
- Domínguez-Muñoz, J. E. Pancreatic exocrine insufficiency: Diagnosis and treatment. Journal of Gastroenterology and Hepatology.2011;26:12–16.
- Australasian guidelines for the management of pancreatic exocrine insufficiency. 2015. Available at: http://pancreas.org.au/wp-content/uploads/2016/01/APC-GUIDELINES-2015.pdf. Accessed on: 2 April 2019
EPI og diabetes
Eksokrin pankreas insuffisiens (EPI) kan oppstå hos pasienter med type 1 eller type 2 diabetes. En mindre vanlig type diabetes - type 3c - kan også være en konsekvens av EPI.11
Ved type 1 eller 2 diabetes er enzym og/ eller bikarbonatsekresjon redusert i direkte funksjoner i pankreas. Imidlertid er nedsatt eksokrin funksjon i de fleste tilfellene mild til moderat, og fører ikke til betydelig redusert fettabsorpsjon.1
Type 3c eller «eksokrin diabetes» oppstår sekundært til bukspyttkjertelsykdom (inkludert pankreatitt, pankreaskreft og cystisk fibrose) skade eller reseksjon.2 Denne typen diabetes har mere utalte symptomer på EPI, enn det som er tilfellet med de som har diabetes type 1 og type 2 diabetes.2
Epidemioligi
Forekomsten av EPI er høyere ved type 1-diabetes enn ved type 2-diabetes: henholdsvis 26% -57% vs. 20% -36%.11 Blant pasienter med diabetes utgjør diabetes type 3c 5-10% av tilfellene i den vestlige verden.2
Årsaker
Ved type 1 og type 2 diabetes kan enhver svekkelse av de lagerhanske øyer også påvirke den eksokrine funksjonen i bukspyttkjertelen negativt og derfor forårsake EPI. Medvirkende faktorer inkluderer pankreasatrofi, vaskulopati og nevropati som sammen reduserer fordøyelsesenzymsekresjonen. I tillegg kan akutt hyperglykemi svekke bukspyttkjertelens eksokrine sekretoriske kapasitet.11
Etiologiene av type 3c-diabetes inkluderer kronisk pankreatitt (76% -79%), kreft i bukspyttkjertelen (8% -9%), arvelig hemokromatose (7% -8%), cystisk fibrose (4%) og etter pankreasreseksjon (2% -3%).2 Alle disse tilstandene er assosiert med EPI av ulike årsaker.2
Patofysiologi
EPI komplikasjoner som følge av diabetes type 1 og 2.10
Autoimmun destruksjon av de insulinproduserende cellene i de Langehanske øyer i pankreas ved type 1-diabetes, kan også ha en effekt på den eksokrine pankreasfunksjonen. Dette kan føre til:11
- Negativ effekt fra høyt glukagon-nivå.
- Vaskulær skade som skyldes sykdom i små kar
- Nedsatt enteropankreatisk refleks på grunn av autonom nevropati
- Akutt hyperglykemi ved type 1 og type 2 diabetes kan reversibelt svekke den eksokrine pankreastiske sekresjonen.
Reduksjoner i størrelse og endringer i bukspyttkjertelens morfologi og histologi er observert hos pasienter med diabetes på grunn av atrofi, fettinvolusjon og forkalkning. Atrofi er mer uttalt i type 1 enn i type 2 diabetes.2
EPI assosiert med diabetes er vanligvis mild til moderat og fører derfor som regel ikke til steatoré.1
Diabets type 3c
Patofysiologien ved type 3c diabetes er forskjellig fra type 1 og type 2 diabetes, og gjør pasienter spesielt utsatt for postprandial hyperglykemi. De viktigste patologiske egenskapene er:11
- Mangel på insulinsekresjon
- Mangelfull sekresjon av polypeptid i bukspyttkjertelen (hovedsakelig fra bukspyttkjertelen), som kan forhindre eller redusere undertrykkelse av postprandial glukoseproduksjon i lever
- Nedsatt sekresjon av inkretinhormonene, som spiller en viktig rolle i regulering av blodglukosen etter måltid.
Nedsatt glukagonsekresjon sammen med EPI, og en fungerende, eller forbedret perifer insulinfølsomhet, kan føre til episoder med hypoglykemi.
Fakta
Pankreatin kan brukes hos personer med diabetes, og påvirker ikke diabeteskontroll.3
Symptomer
EPI kan være vanskelig å oppdage fordi symptomer ligner på andre gastrointestinale sykdommer.4
EPI forårsaker malabsorpsjon og dårlig fordøyelse,1,5 noe som resulterer i symptomer på steatoré. Denne tilstanden er preget av illeluktende, fettrik avføring, og er den vanligste kliniske manifestasjonen av EPI. Steatoré oppstår vanligvis ikke før langt ut i sykdomsforløpet.6
Imidlertid er steatoré relativt vanlig ved diabetes, av andre grunner enn pankreassvikt - det kan skyldes bakteriell gjengroing i duodenum. Så steatoré er ikke nødvendigvis utløst av EPI hos pasienter med diabetes.1
Komplikasjoner
Komplikasjoner på grunn av malabsorpsjon og underernæring vil kunne påvirke pasientens livskvalitet, og påvirke utfallet av underliggende sykdommer, samt øke sykeligheten og dødeligheten.5,7,8 For å lese mere om dette Komplikasjoner ved EPI
Diagnose
Diagnostisering av diabetes type 3
Diagnostisering av type 3c-diabetes:9
Hovedkriterier for diagnostisering:
- Påvist EPI (i henhold til fekal elastase-1 test eller direkte funksjonstester)
- Sykdom påvist ved billeddiagnostikk (endoskopisk ultralyd, MR, CT)
- Fravær av type 1 diabetes relaterte autoimmune markører
Svakere kriterier:
- Nedsatt beta-cellefunksjon (f.eks. HOMA-B, C-peptid / glukose-forhold)
- Fravær av overflødig insulinresistens (f.eks. HOMA-IR)
- Nedsatt inkretinsekresjon (f.eks. GLP-1, polypeptid i bukspyttkjertelen)
Lave serumnivåer av lipidløselige vitaminer (A, D, E og K)
Diagnostisering av EPI ved diabetes
Problemer med fettabsorpsjon hos pasienter med diabetes kan påvirke glukosemetabolismen, som igjen kan føre til variabel glykemisk kontroll.3 Det er flere tilgjengelige metoder for diagnostisering av EPI. Indirekte metoder som fekal elastase-1 (FE -1) er den brukte testen.1
Ca en av fire pasienter med type 1 eller type 2-diabetes har gastrointestinale symptomer, inkludert steatoré, så dette er ikke nødvendigvis et symptom på EPI hos pasienter med diabetes.10 Personer med diabetes og symptomer på EPI bør teste fekal elastase-1 nivået. Hvis FE-1-nivået er lavt, bør ytterligere undersøkelser som CT-skanning eller endoskopisk ultralyd av bukspyttkjertelen utføres for å bekrefte EPI.3
Behandling
Medisinsk standardbehandling av type 3c-og type 2 diabetes er vanligvis lik. Men det er større hyppighet av EPI hos pasienter med diabetes type 3c. Disse vil ha nytte av behandling med pankreatin.1,2
Pankreatin har en positiv innvirkning på EPI symptomene på hos diabetespasienter, og noen få små studier viser at pankreatin kan være gunstig i forhold til glykemisk kontroll.10 I tillegg til å øke insulinsekresjonen samt forbedringer i postprandial glukosenivå, har pankreatin vist reduksjon i hyppigheten av hypoglykemiske episoder.
Pankreatin gitt i 6 måneder kan forbedre postprandial glukosenivå i plasma og graden av glykosylert hemoglobin hos pasienter med diabetes og kronisk pankreatitt.3
Referanser:
- Angelo Andriulli , Antonio Massimo Ippolito , Virginia Festa, et al : Exocrine Pancreatic Insufficiency, as Assessed by Fecal Elastase-1 Levels, in Diabetic Patients: An Estimate of Prevalence in Prospective Studies J Diabetes Metab 2014, 5:6
- Singh VK, Haupt ME, Geller DE, Hall JA, et al. Less common etiologies of exocrine pancreatic insufficiency. World J Gastroenterol. 2017;23(39):7059-7076.
- Cummings M. Pancreatic exocrine insufficiency in type 1 and type 2 diabetes – more common than you think? Journal of Diabetes Nursing. 2014;18: 320-323.
- Leeds JS, Oppong K, Sanders DS. The role of fecal elastase-1 in detecting exocrine pancreatic disease. Nat Rev Gastroenterol Hepatol. 2011;8:405-15.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Domínguez-¬Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12-16.
- Ockenga J. Importance of nutritional management in diseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Fitzsimmons D, Kahl S, Butturini G, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Ewald N, Bretzel RG. Diabetes mellitus secondary to pancreatic diseases (Type 3c): are we neglecting an important disease? Eur J Intern Med. 2013;24(3):203-6.
- Cummings MH, Chong L, Hunter V, et al. Gastrointestinal symptoms and pancreatic exocrine insufficiency in type 1 and type 2 diabetes. Pract Diabetes. 2015;32(2):54-8.
- Matteo Piciucchi, Gabriele Capurso, Livia Archibug, et al, Exocrine Pancreatic Insufficiency in Diabetic Patients: Prevalence, Mechanisms, and Treatment, Int J Endocrinol. 2015; 2015: 595649.
EPI hos pasienter med cøliaki og kronisk inflammatorisk tarmsykdom (IBD)
Eksokrin Pankreas Insuffisiens (EPI) er en tilstand med mangel på eksokrine bukspyttkjertelenzymer, noe som resulterer i malabsorpsjon og dårlig fordøyelse.2 Det er dokumentert at EPI er assosiert med pankreassykdommer som akutt og kronisk pankreatitt, cystisk fibrose, bukspyttkjertelkreft, etc. Men man har også sett økt forekomst ved sykdommer utenfor pankreas som cøliaki (CD) og inflammatorisk tarmsykdom (IBD).1,2
Cøliaki (nontropical sprue, gluten enteropati), er en immunmediert lidelse som først og fremst påvirker tynntarmen. Tynntarmsskade utvikles gradvis fra normal morfologi til tydelig totteatrofi med krypthyperplasi. Dette svekker tarmens absorpsjonsevne, noe som resulterer i diaré, malabsorpsjon og relaterte systemiske endringer.2 Selv om det er allment anerkjent at cøliaki kan være tilstede uten gastrointestinale symptomer; så er diaré fortsatt det mest uttalte symptomet. Cøliaki er assosiert med EPI; mens forekomsten av alvorlig EPI hos pasienter med cøliaki er ikke så hyppig, derimot ser man oftere mild til moderat EPI hos pasienter med cøliaki.3
Studier har vist at pasienter med Inflammatorisk tarmsykdom har en økt forekomst av EPI.2 IBD- inkludert Crohns sykdom og ulcerøs kolitt - er en tilstand med kronisk tilbakevendende inflammasjon i tarmen. Dette er et resultat av en avvikende og vedvarende immunrespons mot mikrober i tarmen, katalysert av genetiske forhold hos pasienten.4,5
Epidemiologi ved Cøliaki, IBD sammen med EPI
Den totale globale prevalensen av cøliaki er estimert til 1,4%. Tar man kun den som er bekreftet med biopsi så er prevalensen 0,7%. Den høyeste prevalensen er rapportert i Europa (0,8%) og Asia (0,8%). Den laveste rapporterte prevalensen er i Sør-Amerika (0,4%)6
Eksokrin Pankreas insuffisiens har økt forekomst hos personer med cøliaki og er en kjent årsak til kronisk diaré. Studier gjort på cøliaki pasienter med vedvarende diare har vist at 15-30% har EPI påvist med lav fekal elastase-1 test.3.5
Epidemiologien til EPI hos pasienter med IBD er ikke helt kjent. Prevalensen av cøliaki varierer avhengig av pasientvalg og hvilke diagnostiske tester som er brukt. En prospektiv studie estimerte en prevalens på 14% –22% EPI hos IBD-pasienter målt med fekal elastase-1-test, mens en annen studie som brukte Endoskopisk sekretinstimulert test (EST), viste at 58-80% av pasientene hadde lave verdier av lipase. (figur 1). Risikoen for å utvikle EPI har vist seg høyere hos IBD-pasienter med løs avføring, hyppigere avføring og som har utført kiurgi.4,5
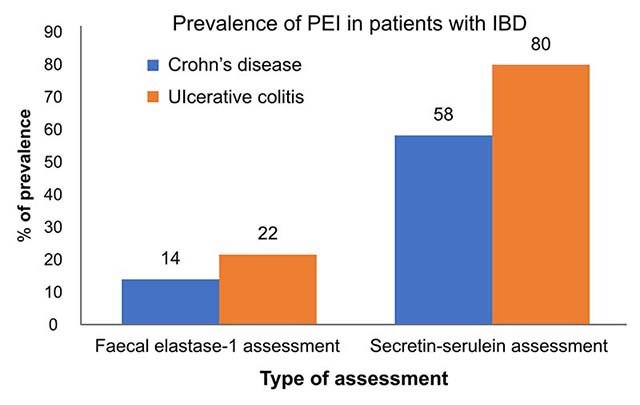
Figur 1: Prevalens av EPI hos pasienter med IBD.6
Patofysiologi ved cøliaki, IBD sammen med EPI
Cøliaki er et resultat av en interaksjon mellom genetiske faktorer (HLADQ2 / DQ8-serotypen), miljøfaktorer (gluteninntak) og immunologiske faktorer (strukturell skade på tarmslimhinnen).2
Eksokrin Pankreas insuffisiens hos pasienter med cøliaki vil svanligvis være multifaktoriell. Mulig faktorer som fører til cøliaki-mediert EPI:3
- Deregulering av pankreasfunksjonen på grunn av unormal respons på intraluminalt aktivitet.
- Nedsatt frigjøring av kolecystokinin, som fører til asynkroni mellom gastrisk tømming, frigjøring av bukspyttkjertelenzymer og galleblæresammentrekning.
- Høyere nivåer av plasmapeptid YY - et hormonpeptid med dyp inhiberende effekt på magesyresekresjon, gastrointestinal motilitet og pankreasenzymutgang
Ovennevnte abnormiteter sammen med villøs atrofi kan føre til redusert enzymproduksjon i pankreas med påfølgende steatoré.3
Etiologien til IBD er fortsatt ganske ukjent. Forskning peker på genetiske faktorer, det ytre miljøet, tarmens mikrobielle flora og immunrespons i patogenesen av IBD.7
Symptomer på EPI
Eksokrin Pankreas insuffisiens fører til en rekke symptomer avhengig av alvorlighetsgrad:2
- Steatoré (illeluktende, fet avføring)
- Magesmerter
- Flatulens
- Vekttap
- Underernæring
Symptomene på EPI er ofte like de vi ser ved andre gastrointestinale sykdommer, noe som kan føre til at sykdommen ikke blir diagnostisert. Steatoré som er det mest uttalte symptomet på EPI kommer ofte i en sen fase av sykdommen.
Eksokrin pankreas insuffisiens er også forbundet med mangler på fettløselige vitaminer (vitamin A, D, E og K), magnesium, kalsium og essensielle fett- og aminosyrer.9
Komplikasjoner ved EPI
Komplikasjoner fra malabsorpsjon og underernæring kan ha en negativ effekt på pasientens livskvalitet og kan påvirke underliggende lidelser samt påskynde morbiditet og mortalitet.10-12
Les mere her om komplikasjoner ved EPI.
Diagnostisering av EPI
Det er flere tilgjengelige tester for å diagnostisere EPI. Disse kan enkelt deles opp i direkte og indirekte.
Indirekte tester vurderer følgelende av EPI - ved å måle nivå av fett i avføringen, (brukes kun i studiesammenheng) eller nivåene av fekal elastase-1. Elastase-1 er den mest brukte testen i dag fordi den er billigere og lettere å utføre sammenlignet med direkte funksjoner i bukspyttkjertelen.
Direkte tester viser pankreas enzymproduksjonen direkte. Selv om de har bedre spesifisitet, utføreres de mindre i klinikken fordi de er invasive, tidkrevende og dyre å utføre. Videre viser de ikke på sammen måte responsen på pankreatin-behandling, samt at de ikke er standardiserte.2
Pasienter med cøliaki har ofte diaré (som ikke er relatert til EPI). Dette kan senke konsentrasjonen av fekal elastase-1, og derfor gi et falskt positivt resultat på testen.4 Videre kan de kliniske symptomene på IBD kan overskygge andre pankreassykdommer; derfor blir diagnoseringen av pankreaslidelser ved IBD vanskelig. På grunn av dette er det viktig å utrede IBD-pasienter med symptomer på pankreaslidelse grundig for å utelukke eventuelt andre pankreassykdommer.4
Behandling av EPI hos pasienter med Cøliaki og IBD
Som ved andre årsaker til EPI, pankreatin er også førstelinjebehandling ved cøliaki og IBD mediert EPI, behandling av EPI. Pankreatin kompenserer for mangelen på enzymsekresjon. Pankreatin bør tilpasses individuelt etter sykdommens alvorlighet og pasientens behov. Pankreatin-behandling har i studier vist god effekt på symptomlindring hos EPI-pasienter med cøliaki og IBD.3.5.8
Fordøyelsesenzymer som behandler symptomer på EPI, kan i tillegg bidra til enzymatisk nedbrytning av gluten, som ellers metaboliseres dårlig og kan utløse underliggende immunrespons, noe som fører til cøliaki.
En prospektiv langtidsstudie evaluerte effekten av Pankretin hos cøliaki-pasienter med diaré og lav fekal elastase-1. Den viste pankreatin førte til symptomlindring. Langtidsdata antydet også at pankreatin kunne avsluttes hos en betydelig andel pasienter som når symptomene bedret seg. (Figur 2).3
Viktig:3.5
- Eksokrin pankreas insuffisiens er en vanlig og ofte udiagnostisert klinisk tilstand relatert til lidelse i pankreas eller utenfor. Den har potensielt skadelige effekter som malabsorpsjon som fører til underernæring.
- Tidlig diagnostisering av EPI fører til at du kan starte med behandling før mer alvorlige komplikasjoner oppstår.
- Erstatningsterapi i pankreas har vist å gi symptombedring hos pasienter med cøliaki og IBD-pasienter som har diaré og lav fekal elastase-1.
Referanser:
- Domínguez-Muñoz JE. Pancreatic enzyme replacement therapy: Exocrine pancreatic insufficiency after gastrointestinal surgery. HPB (Oxford). 2009;11(3):3–6.
- Capurso G, TrainiM, Piciucchi M, et al. Exocrine pancreatic insufficiency: Prevalence, diagnosis, and management. Clin Exp Gastroenterol. 2019;12:129–139.
- Evans KE, Leeds JS, Morley S, et al. Pancreatic insufficiency in adult celiac disease: Do patients require long-term enzyme supplementation? Dig Dis Sci.2010;55:2999–3004.
- Fousekisa FS, Theopistosa VI, Katsanos KH, et al. Pancreatic involvement in inflammatory bowel disease: A review. J Clin Med Res. 2018;10(10):743–751.
- Maconi G, Dominici R, Molteni M, et al. Prevalence of pancreatic insufficiency in inflammatory bowel diseases:Assessment by fecal elastase-1. Dig Dis Sci. 2008;53(1):262–270.
- Singh P, Arora A, Strand TA, et al. Global prevalence of celiac disease: Systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2018;16:823–836.
- Zhang Y, Li Y. Inflammatory bowel disease: Pathogenesis. World J Gastroenterol. 2014;20(1):91–99.
- Leeds JS, Hopper AD, Hurlstone DP, et al. Is exocrine pancreatic insufficiency in adult coeliac disease a cause of persisting symptoms? Aliment PharmacolTher. 2007;25:265–271.
- Lohr JM, Dominguez-Munoz E, Rosendahl E, et al. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterology Journal.2017;5(2):153–199.
- Tignor AS, Wu BU, Whitlock TL, et al. High prevalence of low-trauma fracture in chronic pancreatitis. Am J Gastroenterol. 2010;105(12):2680–2686.
- Shintakuya R, Uemura K, Murakami Y, et al. Sarcopenia is closely associated with pancreatic exocrine insufficiency in patients with pancreatic disease. Pancreatology. 2017;17(1):70–75. de la Iglesia-Garcia, Vallejo-Senra N, Lopez-Lopez A, et al. Effect of pancreatic exocrine and endocrine insufficiency in cardiovascular events in patients with chronic pancreatitis (CP). A prospective cohort study. Pancreatology.2018;(18):1–188.
Gastrointestinal kirurgi
Flere sykdommer som kronisk pankreatitt, kreft, crohns sykdom og traumer kan medføre gastrointestinal (GI) kirurgi.1,2 Avhengig av type kirurgi, kan dette direkte eller indirekte føre til EPI.4,6
Etter GI kirurgi og pankreaskirurgi er EPI påvist hos 80%.7
Etter total gastrektomi og duodenal pankreatektomi vil de fleste utvikle EPI.7 Ved kirurgi etter pankreaskreft er det påvist EPI hos 80% av pasientene.5 Pankreasreseksjon i hode av pankeras er assosiert med lavere EPI-frekvens, og distal pankreatektomi kan bevare bukspyttkjertelens eksokrine funksjon helt.6
Årsaker
Ved en større pankreasreseksjon reduseres sekresjonsevnen i bukspyttkjertelen, inkludert eksokrin sekresjon. Pasienten vil utvikle kliniske symptomer på EPI, avhenge av patologien, typen og omfanget av reseksjonen.4,6
Etter gastrokirurgi vil noen pasienter utvikle EPI i mer eller mindre grad.3 Hos pasienter med mer alvorlige tarmsymptomer kan EPI føre til magesmerter, steatoré, vekttap og forringet livskvalitet.3 Delvis eller total gastrektomi kan føre til redusert enzymproduksjon i pankreas etter et måltid,3 hovedsakelig på grunn av asynkroni mellom gastrisk tømming og frigjøring av galle- og bukspyttkjertelenzymer i tynntarmen (postcibal asynkroni), men også denervering av pankreas etter vagotomi.4,6 Pankreatisk-biliær bypass fører til en total asynkroni.6 Omfattende tarmreseksjoner fører også til redusert endogen stimulering og postcibal asynkroni.4,6 GI-tilpasning etter omfattende tynntarmsreseksjon fører til kompenserende økninger i utskillelsen av gastrin og pentagastrin i plasma. Man antar at dette påvirker størrelsen og sammensetningen av bukspyttkjertelen.6 Videre kan bakteriell gjengroing forårsake for tidlig enzymnedbrytning.6
Patafysiologi
Pankreaskreft og kronisk pankreatitt vil ofte medføre kirurgi i bukspyttkjertelen.5 Noen ganger vil alvorlig magesår som man ikke klarer å behandle medikamentelt, medføre gastrokirurgi.6 Kirurgisk biliær bypass, som også fjerner en del av magen, er en prosedyre som brukes til å behandle alvorlig fedme.6
Tarmreseksjon brukes til å behandle Crohns sykdom, svulster, iskemi og traumer. Kirurgisk biliær bypass medfører også redusert funksjon i tynntarmen.6
Symptomer
EPI fører til malabsorpsjon og dårlig fordøyelse, som medfører, vekttap, magesmerter, tretthet, diaré, steatoré og flatulens.5,6
Steatoré preget av illeluktende, fet avføring, er et tegn på alvorlig EPI.6,7 Malabsorpsjon ved EPI, som fører til steatoré, vekttap og underernæring, vil medføre mangler på fettløselige vitaminer: A, D , E og K, mineraler og essensielle fett- og aminosyrer.5,7
Ved kirurgi etter kronisk pankreatitt vil et betydelig antall oppleve alvorlig EPI og steatoré.1
Komplikasjoner
Komplikasjoner fra malabsorpsjon og underernæring kan ha en negativ effekt på pasientens livskvalitet og kan påvirke underliggende lidelser samt påskynde morbiditet og mortalitet.5,7 Les mere om komplikasjoner ved EPI.
Diagnostisering av EPI
Det er flere tilgjengelig tester for diagnostisering av EPI. I klinikker brukes som regel den indirekte elastase-1 testen fordi den er enkel, rimelig og ikke invasiv.6
Les her for mer informasjon om diagnostisering av EPI.
Behandling
EPI etter kirurgi behandles på samme måte som EPI som skyldes kronisk pankreatitt.7
Pankreaskirurgi: Alvorlighetsgraden av EPI kan variere, og derfor bør doseringen av Pankreatin individualiseres. Vanligvis kreves 40.000-50.000 enheter lipase til hvert hovedmåltid.8,9 Tilleggsbehandling med syrenøytraliserende legemidler kan være nødvendig.6
Gastrokirurgi: Pankreatin etter gastrokirurgi bør vurderes i tilfeller med symptomer på malabsorpsjon og steatoré, og vil ofte bedre symptomene. Pankreatin bør doseres individuelt basert på symptomer. Generell anbefalt dosering er 40 000 lipaseenheter pr. hovedmåltid,8,9 men dersom kirurgi fører til hyppigere og mindre måltider bør denne dosen reduseres.6
Reseksjon av tynntarm: Ved symptomer på EPI etter tynntarmskirurgi anbefales behandling med pankreatin. Pankreatin bør doseres individuelt basert på symptomer. Generell anbefalt dosering er 40 000 lipaseenheter pr. hovedmåltid,8,9 men dersom tynntarmskirurgi fører til hyppigere og mindre måltider bør denne dosen reduseres. I ekstreme tilfeller kan total parenteral ernæring være nødvendig.10 Annen behandling kan være antimotilitetsmidler for å redusere tarmtransitt, magesyre hypersekresjons dempende midler, antibiotika og / eller probiotika for å undertrykke bakteriell gjengroing i tarmen og / eller rekombinant humant veksthormon for å forbedre tarmtilpasningen og dermed forbedre næringsopptaket.6
Langtidsbehandling og oppfølging for EPI hos pasienter etter GI kirurgi
Etter kirurgi i pankreas bør alle pasienter jevnlig utredes for EPI og symptomer som vekttap, diaré, steatoré og økt nivå av fett I feces > 15 g / dag.3
I tilfeller av tarmreseksjon er behandling av ernæring kompleks og bør tilpasses individuelt. Henvisning til ernæringsfysiolog er derfor anbefalt.6
Referanser:
- Dilip Parekh, Sathima Natarajan, Surgical Management of Chronic Pancreatitis, Indian J Surg. 2015 Oct; 77(5): 453–469.
- Robert T. Lewis, David J. Maron, Efficacy and Complications of Surgery for Crohn's Disease, Gastroenterol Hepatol (N Y). 2010 Sep; 6(9): 587–596.
- Miroslav Vujasinovic, Roberto Valente, Anders Thorell, et al, Pancreatic Exocrine Insufficiency after Bariatric Surgery, Nutrients. 2017 Nov; 9(11): 1241.
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl VI):vi1–vi28.
- Sikkens EC, Cahen DL, van Eijck C, et al. The daily practice of pancreatic enzyme replacement therapy after pancreatic surgery: a Northern European survey. enzyme replacement after surgery. J Gastrointest Surg. 2012;16:1487–1492.
- Smith RC, Smith SF, Wilson J, et al. Australasian guidelines for the management of pancreatic exocrine insufficiency. Australasian Pancreatic Club. October 2015. pp 1–122.
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12–16.
- Creon 10000, 25000, 35000 SPC punkt 4.2 (01.11.2021)
- Norsk veileder for diagnostikk og behandling av kronisk pankreatitt, NGF-Nytt nr 4. – Desember 2016
- Norsk legemiddelhåndbok, T23.1.3 Parenteral ernæring, Publisert: 20.02.2017
Inflammatorisk tarmsykdom (IBD)
Inflammatorisk tarmsykdom (IBD) består av tarmsykdommene chrons sykdom og ulcerøs kollitt.1
Genetiske faktorer, miljøpåvirkninger og tarmfloraen kan sammen lede til en unormal immunrespons i tarmen.1 Dette igjen fører til betennelsen i tarmen. IBD kan påvirke flere andre organer enn tarmene.1 Avvik i pankreas ved IBD er vanlig og kan føre til akutt og kronisk pankreatitt, autoimmun pankreatitt og asymptomatiske pankreasavvik.1,2 Pasienter med IBD har økt risiko for å utvikle EPI. Denne risikoen øker hvis de har minst tre avføring per dag, løs avføring, og etter kirurgi.2
Epidemiologi
Eksokrin pankreas insuffisiens (EPI) er påvist hos 21% av pasientene med IBD ved bruk av BT-PABA-test, bentimomid-test.3 Ved Crohns sykdom er EPI påvist ved lave fekal elastase-1 nivåer sett hos 14-30% av pasientene, og unormal fettutskillelse sett hos 17-35% av pasientene.3 Ved ulcerøs kolitt har man påvist EPI hos 22% målt med fekal elastase-1 nivåer ≤200 μg / g, og 50% har bikarbonat og / eller enzyminsuffisiens.3
Årsaker
Det er uklart hvorfor pankreassekresjonen er redusert ved IBD.2 Ved Crohns sykdom kan det være forårsaket av underernæring, eller av betennelse og / eller arrdannelse i tarmveggen. Direkte skade på bukspyttkjertelen kan også være en medvirkende faktor.2 EPI har også blitt påvist hos pasienter med IBD uten kliniske symptomer. Denne typen EPI regnes forbigående for noen av pasientene.1
EPI kan også være et symptom på kronisk pankreatitt hos pasienter med IBD.1,2 I de fleste av disse tilfellene er det en idiopatisk kronisk pankreatitt.1 Undersøkelser tyder på at denne typen kronisk pankreatitt er en ekstraintestinal manifestasjon av IBD.1
Patofysiologi
Den eksakte patofysiologien til EPI ved IBD er ukjent. Mulige mekanismer i crohns sykdom er autoantistoffer i bukspyttkjertelen (påvist hos omtrent en tredjedel av pasientene), duodenal refluks og redusert sekretorisk hormonproduksjon.2,3 Arr eller betennelse kan redusere tarmhormonsekresjon, noe som kan redusere eksokrin funksjon i bukspyttkjertelen på grunn av utilstrekkelig stimulering.3 Både ved Crohns sykdom og ulcerøs kolitt er det sett patologiske endringer i bukspyttkjertelen som kan hindre utskillelsen av fordøyelsesenzymer.3
Symptomer
Som regel vil pasienter med IBD ha mild til moderat EPI uten kliniske symptomer som steatoré.3 Imidlertid kan pasienter med Crohns sykdom som har redusert absorpsjonskapasitet på grunn av omfattende betennelser, tynntarmsreseksjoner, arr eller motilitetsforstyrrelser, utvikle symptomer.4
EPI fører til malabsorpsjon og dårlig fordøyelse, noe som resulterer i symptomer som: vekttap, magesmerter, tretthet, diaré, steatoré og flatulens.5,6
Steatoré medfører illeluktende, fet avføring, og er den vanligste kliniske manifestasjonen av EPI. Denne kommer sent i sykdomsforløpet, og er et symptom på alvorlig EPI.6,7 Ved crohns sykdom kan mild EPI bli symptomatisk på grunn av redusert absorberende kapasitet.4
Komplikasjoner
Komplikasjoner fra malabsorpsjon og underernæring kan ha en negativ effekt på pasientens livskvalitet og kan påvirke underliggende lidelser samt påskynde morbiditet og mortalitet.8,9
Les mere her om komplikasjoner ved EPI.
Diagnostisering
Det er flere metoder tilgjengelig for diagnostisering av EPI, med indirekte tester er mest brukt i klinikk.6 Fekal elastase-1 test for pankreasfunksjon er den foretrukne testen. Dette fordi den er enkel å ta for pasienten, ikke invasiv og rimelig.10
Les mere her om diagnostisering av EPI.
Behandling
Selv om forekomsten av EPI er relativ høy ved IBD, er det få kliniske data eller retningslinjer for bruk av pankreas enzymerstatningbehandling (Pankreatin) hos disse pasientene.3 Men det er påvist i studier at pasienter med IBD, og samtidig symptomer på EPI, kan ha nytte av Pankreatin.5 Les mere her om behandling av EPI med Pankreatin, dosering og andre aspekter av EPI behandling.
Referanser:
- Lídia Roque Ramos, David B. Sachar, Christopher J. DiMaio, et al, Inflammatory Bowel Disease and Pancreatitis: A Review, Journal of Crohn's and Colitis, Volume 10, Issue 1, January 2016, Pages 95–104
- Antonini F, Pezzilli R, Angelelli L, Macarri G. Pancreatic disorders in inflammatory bowel disease. World J Gastrointest Pathophysiol. 2016;7(3):276–282.
- Singh VK, Haupt ME, Geller DE, et al, Quintana Diez PM. Less common etiologies of exocrine pancreatic insufficiency. World J Gastroenterol. 2017;23(39):7059–7076.
- Keller J, Layer P. Human pancreatic exocrine response to nutrients in health and disease. Gut. 2005;54(Suppl VI):vi1–vi28.
- Sikkens EC, Cahen DL, van Eijck C, et al. The daily practice of pancreatic enzyme replacement therapy after pancreatic surgery: a Northern European survey. enzyme replacement after surgery. J Gastrointest Surg. 2012;16:1487–1492.
- Norsk veileder for diagnostikk og behandling av kronisk pankreatitt, NGF-Nytt nr 4. – Desember 2016
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12–16.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Fitzsimmons D, Kahl S, Butturini G, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Thomas PD, Forbes A, Green J, et al. Guidelines for the investigation of chronic diarrhoea, 2nd edition. Gut. 2003;52(Suppl 5):v1–15.
Irritabel tarm syndrom (IBS)
Irritabel tarm syndrom (IBS) er en vanlig tilstand som er preget magesmerter, ubehag, oppblåsthet, diaré og forstoppelse.1 For de fleste oppstår dette episodisk, men for noen er dette en kronisk tilstand.2 En liten andel av IBS-pasientene har også symptomer forbundet med eksokrin pankreasinsuffisiens (EPI).1 Dette kan være på grunn av kronisk pankreatitt,1 som har noen sammenfallende symptomer med EPI.1,3 Andre pasienter kan også ha en udiagnostisert cøliaki, mikroskopisk kolitt, med mer.2
IBS er påvist hos opptil 37% av befolkningen.1,2
EPI er påvist hos 5-6% av personer med IBS.1,3,4
Mange pasienter med IBS og samtidig EPI plages av diaréer, samt at det er en del fellestrekk med disse to tilstandene.2 Dette støttes av bildediagnostikk som viser skader i pankreas hos noen av disse pasientene.1
Les mere her om årsakene til EPI ved cøliaki
Patofysiologi
Patofysiologien til IBS er ikke så godt kjent, men endringer i motoriske og sensoriske tarmfunksjoner og hjerne-tarm-aksen er mulige forklaringer.2 IBS kan også være en følge av smittsom gastroenteritt.2 Imidlertid har lave fekal elastase-1 nivåer under 100 μg / g blitt vist hos ca. 6% av pasientene med diaré-dominerende IBS (D-IBS), noe som indikerer alvorlig EPI.1 Dette antyder at pankreas kan være årsaken til IBS-symptomene.1
Symptomer
EPI fører til malabsorpsjon og dårlig fordøyelse, med påfølgende symptomer som, vekttap, magesmerter, tretthet, diaré, steatoré og flatulens.5
Steatoré, preget av illeluktende og fet avføring, kommer sent i forløpet, og er et symptom på alvorlig EPI.6 EPI med malabsorpsjon og symptomer som steatoré, vekttap og underernæring fører til mangler på de fettløselige vitaminene: A, D, E og K, mineraler og essensielle fett- og aminosyrer.5,6
Komplikasjoner
Komplikasjoner fra malabsorpsjon og underernæring kan ha en negativ effekt på pasientens livskvalitet og kan påvirke underliggende lidelser samt påskynde morbiditet og mortalitet.7-9
Les mer her om komplikasjoner ved EPI.
Diagnostisering av EPI
Det er flere metoder tilgjengelig for diagnostisering av EPI, men indirekte tester er mest brukt i klinikk.6 Fekal elastase-1 test for pankreasfunksjon er den foretrukne testen. Dette fordi den er enkel
å ta for pasienten, ikke-invasiv og rimelig.10
Les mere her om diagnostisering av EPI
Behandling
Pankreatin har vist symptombedring på magesmerter, avføringsfrekvens og avføringskonsistens hos pasienter med IBS.11
Les mere om behandling av EPI og samtidig cøliaki.
Les mere her om behandlingen av EPI med Pankreatin, dosering, og andre aspekter av EPI behandling.
Referanser:
- Leeds JS, Hopper AD, Sidhu R, et al. Some patients with irritable bowel syndrome may have exocrine pancreatic insufficiency. Clin Gastroenterol Hepatol. 2010;8(5):433-438.
- Leeds JS, Hopper AD, Hurlstone DP, et al. Is exocrine pancreatic insufficiency in adult coeliac disease a cause of persisting symptoms? Aliment Pharmacol Ther. 2007 Feb 1;25(3):265-71.2
- Talley NJ, Holtmann G, Nguyen QN, et al. Undiagnosed pancreatic exocrine insufficiency and chronic pancreatitis in functional GI disorder patients with diarrhea or abdominal pain. J Gastroenterol Hepatol. 2017;32(11):1813-1817.
- Lindkvist B, Törnblo H, Simrén M. The prevalence of pancreatic exocrine insufficiency in patients fulfilling Rome III criteria for irritable bowel syndrome. Pancreatology 2013;13(3 Suppl):S72 (Abstract PII-65).
- Sikkens EC, Cahen DL, van Eijck C, et al. The daily practice of pancreatic enzyme replacement therapy after pancreatic surgery: a Northern European survey. enzyme replacement after surgery. J Gastrointest Surg. 2012;16:1487–1492.
- Domínguez-Muñoz JE. Pancreatic exocrine insufficiency: diagnosis and treatment. J Gastroenterol Hepatol. 2011;26(Suppl 2):12–16.
- Sikkens EC, Cahen DL, van Eijck C, et al. Patients with exocrine insufficiency due to chronic pancreatitis are undertreated: a Dutch national survey. Pancreatology. 2012;12(1):71-73.
- Ockenga J. Importance of nutritional management in diseases with exocrine pancreatic insufficiency. HPB (Oxford). 2009;11(Suppl 3):11-15.
- Fitzsimmons D, Kahl S, Butturini G, et al. Symptoms and quality of life in chronic pancreatitis assessed by structured interview and the EORTC QLQ-C30 and QLQ-PAN26. Am J Gastroenterol. 2005;100(4):918-926.
- Thomas PD, Forbes A, Green J, et al. Guidelines for the investigation of chronic diarrhoea, 2nd edition. Gut. 2003;52(Suppl 5):v1–15.
- J-Matthias Löhr, Mark R Oliver, Luca Frulloni, et al, Synopsis of recent guidelines on pancreatic exocrine insufficiency, United European Gastroenterol J. 2013 Apr; 1(2): 79–83.
Mer informasjon om
Diagnostisering av EPI

Det fins flere tilgjengelige tester for EPI, med varierende pris og kvalitet.
EPI og bakenforliggende sykdom
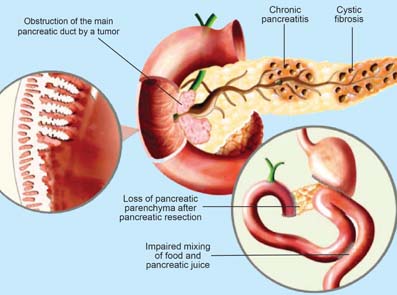
EPI oppstår ikke av seg selv,men er en konsekvens av pankreas skade.
